
2018年4月3日,《Immunity》以在线长文的形式发表了清华大学免疫学研究所董晨教授课题组题为《Co-inhibitory molecule B7 superfamily member 1 expressed by tumor-infiltrating myeloid cells induces dysfunction of anti-tumor CD8+ T cells》的研究论文。该论文深入研究了免疫调节点分子B7S1对抗肿瘤免疫反应中的负调节功能, 揭示了肿瘤微环境中表达于抗原呈递细胞的B7S1可启动CD8+效应T细胞的衰竭过程,并且与PD-1抑制性信号一起协同地诱导T细胞衰竭,阻断B7S1信号有望进一步改善现有anti-PD-1免疫治疗的疗效。
近年来, 肿瘤免疫治疗蓬勃发展, 已经给人类彻底战胜癌症带来了一线曙光。CD8+ T细胞是免疫系统攻击癌症细胞的主要利器。但是在肿瘤微环境里,CD8+ T细胞经常会进入机能缺陷或衰竭状态,从而不能有效地阻止癌症的进展。肿瘤细胞表面上调的抑制性配体PD-L1(Programmed Death-Ligand 1)与CD8+ T细胞上PD-1(Programmed Death-1)的相互作用是介导T细胞衰竭的机制之一;阻断PD-1/PD-L1通路的药物在癌症病人中疗效优于传统治疗手段,并已获FDA批准用于多种癌症的治疗。然而,在大部分癌症类型中,只有小部分病人(20~30%)对anti-PD-1/PD-L1免疫治疗产生应答,非应答者一般经历体内T细胞功能短暂激活后疾病继续进展。因此, 肿瘤微环境PD-1可能与其他分子一起协同地促进T细胞衰竭。
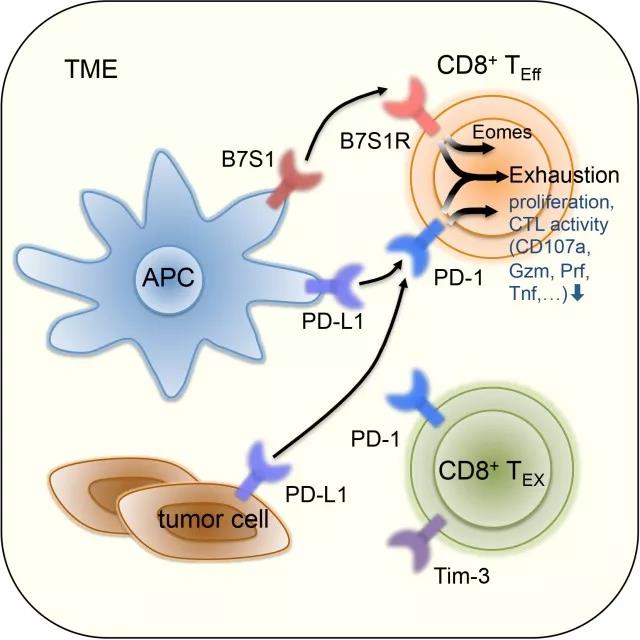
B7 superfamily member 1(B7S1),也称B7-H4、B7x或VTCN1,在2003年被董晨、陈列平和James P. Allison三个实验室几乎同时发现为T细胞的共抑制分子。B7S1过度表达于多种癌症,因此有可能是肿瘤免疫治疗的潜在靶点。在本项研究中, 董晨课题组首先在肝细胞癌(HCC)病人的临床标本中检测B7S1及其受体的表达。在肿瘤微环境中,B7S1高表达于抗原呈递细胞(APC),而它的潜在受体高表达于抗肿瘤效应淋巴细胞,PD-L1则主要表达于肿瘤细胞上,而且HCC病人肿瘤中CD8+ T细胞的功能缺陷与B7S1(而非PD-L1)的表达水平相关。
接着,他们在小鼠肿瘤模型中进一步验证B7S1在抗肿瘤免疫反应中的功能。他们发现阻断B7S1信号通路(B7S1敲除或anti-B7S1治疗)可抑制小鼠HCC (Hepa1-6)和淋巴瘤(A20、E.G7)的进展,在小鼠肿瘤中B7S1的受体(B7S1R)主要表达于CD8+ T细胞,而B7S1信号主要通过抑制APC和CD8+ T细胞的相互作用来实现免疫抑制。然后,他们利用E.G7小鼠模型来研究B7S1信号产生免疫抑制的机制。首先,他们分析了肿瘤中表达B7S1R的CD8+ T细胞的功能状态。B7S1R随着CD8+ T细胞向肿瘤浸润或扩增而上调,在第12天达到最高点后下降,并与PD-1(而非Tim-3)共表达。体内表型分析和RNA-seq分析表明,PD-1+B7S1R+Tim-3-CD8+T细胞处于激活状态,而PD-1+B7S1R-Tim-3+CD8+T细胞处于衰竭状态。通过对比野生型小鼠和B7S1敲除小鼠的表型,他们发现阻断B7S1信号通路可显着提高肿瘤浸润的CD8+ T细胞的数量和效应功能,并抑制T细胞衰竭的进程。体内外功能性实验表明,与T细胞衰竭密切相关的转录因子Eomes直接参与B7S1信号介导的免疫抑制。
由于B7S1R和PD-1共表达于肿瘤微环境中的CD8+ T细胞,而且阻断B7S1信号会导致PD-1的补偿性上调,董晨课题组猜测B7S1和PD-1信号可能会共同促进T细胞衰竭,同时阻断这两个通路可能会进一步增强抗肿瘤免疫力。于是他们对比了anti-B7S1、anti-PD-1单独用药和联合用药在E.G7和Hepa1-6小鼠肿瘤模型中的抑癌效果,研究结果表明,anti-B7S1和anti-PD-1联合治疗可更显着地抑制肿瘤生长。为研究联合治疗产生协同效应的机制,他们对比了经对照抗体、anti-B7S1、anti-PD-1和anti-B7S1+anti-PD-1治疗的小鼠中肿瘤抗原特异性CD8+ TIL的染色质开放区域(ATAC-seq)和转录组(RNA-seq)。CD8+ T细胞内大部分表观遗传修饰、基因表达以及信号通路由B7S1R和PD-1共同调控,表达于同一种细胞类型的B7S1R和PD-1可能通过作用于共同的下游信号分子来协同地抑制抗肿瘤CD8+ T细胞的功能,为anti-PD-1免疫治疗在癌症病人中应答率低的现象提供了理论依据。anti-B7S1和anti-PD-1治疗可进一步提高CD8+ TIL的效应功能和增殖存活能力,因此,在临床应用中,anti-B7S1和anti-PD-1联合用药有望进一步改善目前anti-PD-1免疫治疗的疗效。
董晨教授为本文的通讯作者,清华大学医学院博士生黎静为该论文的第一作者,论文其他合作者还包括来自清华大学、美国安德森癌症研究中心、美国西南医学院、多伦多大学和中日友好医院的研究者。该研究得到了北京市科学技术委员会、国家自然科学基金委等的资助。(世联博研(Bioexcellence)世联博研Bioexcellence)
尊敬的 先生/女士
您已注册成功,注册信息及注意事项已发到联系人及参会人邮箱,请注意查收。如未收到,请联系大会联系人。