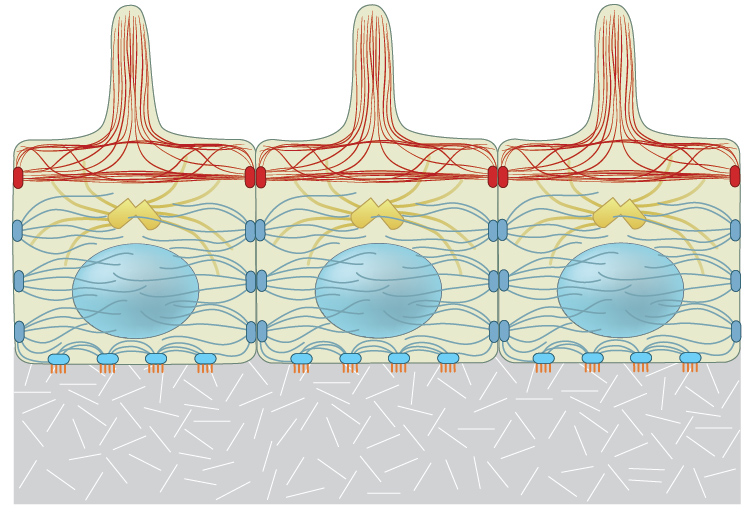
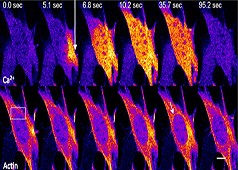
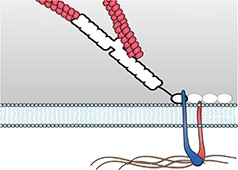
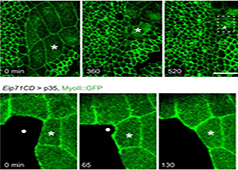
细胞和亚细胞结构经历来自各种来源的力。一般来说,力是通过细胞骨架从细胞内产生的(内源力)或来自细胞外的力(外加力)。施加在细胞上的力在本质上通常是动态的,需要细胞不断重新评估其状态并相应地调整其内部和外部形态。虽然机械传感器和机械转导事件在细胞外围局部发生,力和生化信号在整个细胞中传递[1]、[2]、[3]、[4]并随着时间的推移整合[5]、[6]。通常,它们促进细胞骨架丝的硬化、软化和重新定向[7]、[8]、[9]。这导致在不干扰细胞连接的情况下加强整个收缩机制(在[10]中进行了评论)。
内源力
在细胞骨架组装过程中,细丝亚基遇到分子间结合力,吸引(拉动或拉紧)其相邻亚基。这些力被分子内抵抗被压缩的阻力所抵消。大多数组件和相关蛋白质中存在的刚性和柔性区域赋予细丝弹性并“预应力”整个系统以抵抗变形力,例如延伸、弯曲和压缩(在[11] [12]中进行了评论)。
在非肌肉细胞中,肌动球蛋白机制提供了对变形的收缩阻力(施加力/应力时)。这种机械通过改造和施加产生张力牵引力对细胞-细胞和细胞-基质的粘附(应变),从而在细胞内产生静息张力(在[12] [13]中进行了综述)(参见下面的“图:收缩机械提供对变形的抵抗力”)。
这种收缩张力代表了细胞用来耦合外部和内部机械转导事件的反馈系统(在[14]中进行了评论)。应力与应变稳态的变化会影响哪些不同的机械传感器协同工作以协调一致的响应并控制信号的集成方式[15]、[16]。
外加力
细胞和组织经受的外力包括张力、压缩、剪切、膨胀和膜曲率。弹性和预应力,收缩机械立即响应其环境的几何、地形或空间分布的微米和纳米变化[17]、[18]、[19]、[20]、[21]、[22] .
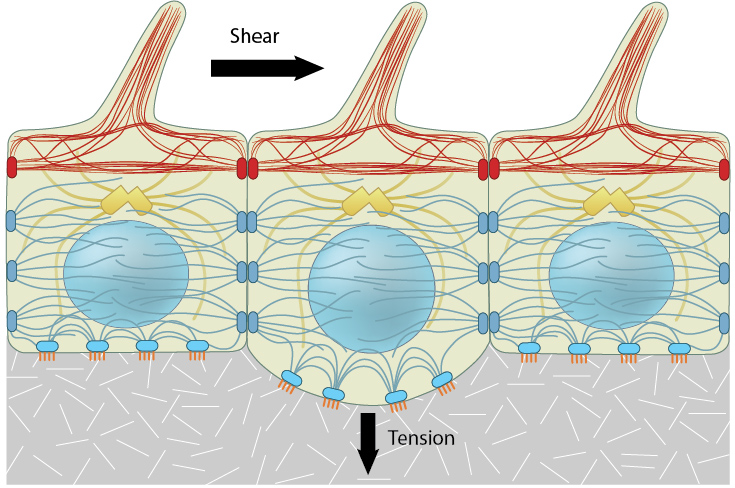
施加的力(例如剪切应力或张力)由位于施加应力的细胞表面附近的机械传感器检测。由此产生的力诱导的机械感觉分子构象变化在整个相互连接的细胞骨架系统中传递,并集中在网络内的其他机械传感器上。对施加的力的一致的quan局机械响应不仅可以通过直接信号转导途径影响基因表达,还可以通过细胞骨架元件和相互连接的核膜的力传递来影响基因表达。
在宏观尺度上施加的力会导致细胞-细胞或细胞-基质关联的强度发生变化。这会激活机械传感器并通过细胞膜、粘附受体和粘着斑通过细胞网络向下传递信号。特定途径将力集中在包含功能模块的蛋白质复合物上[23] [24] [25]。这些机械转导事件使细胞能够区分化学性质[26] [27] 和下层表面的刚度[28],以及特定类型的细胞外基质(ECM) 纤维 [37]。这些因素影响导致细胞形态改变的下游信号传导和细胞骨架事件[29]。
响应于外部机械力而加强收缩机械,zui终在 ECM 内产生相反的力。这导致 ECM 重塑以恢复体内平衡并加强粘连以抵抗更高的力[1]。因此,该过程在机械传感和转导系统内创建了一个反馈回路。
细胞骨架的某些成分,即微管和肌动蛋白丝,承受压力以抵消预应力元件中的张力。其他元素,即中间丝,对于通过细胞质的长力传递以及细胞质和细胞核的结构整合是必需的(在[12]、[10]、[30]中进行了综述)。
参考
- Choquet D、Felsenfeld DP 和 Sheetz MP。细胞外基质刚性导致整合素-细胞骨架连接的加强。 细胞 1997; 88 (1) :39-48。[PMID:9019403 ]
- Riveline D、Zamir E、Balaban NQ、Schwarz US、Ishizaki T、Narumiya S、Kam Z、Geiger B 和 Bershadsky AD。作为机械传感器的焦点接触:外部施加的局部机械力通过依赖 mDia1 和du立于 ROCK 的机制诱导焦点接触的生长。 J.细胞生物学。 2001; 153 (6) :1175-86。[PMID:11402062 ]
- Galbraith CG、Yamada KM 和 Sheetz MP。力与焦点复合体发展的关系。 J.细胞生物学。 2002; 159 (4) :695-705。[PMID:12446745 ]
- von Wichert G、Jiang G、Kostic A、De Vos K、Sap J 和 Sheetz MP。RPTP-alpha 充当 alphav/beta3-整合素-细胞骨架连接上的机械力传感器。 J.细胞生物学。 2003; 161 (1):143-53。[PMID:12682088 ]
- Discher DE、Janmey P 和 Wang Y.组织细胞感觉并响应其基质的硬度。 科学 2005; 310 (5751):1139-43。[PMID:16293750 ]
- Giannone G 和 Sheetz MP。底物刚性和力通过酪氨酸磷酸酶和激酶途径定义形状。 趋势细胞生物学。 2006; 16 (4):213-23。[PMID:16529933 ]
- Gardel ML、Nakamura F、Hartwig JH、Crocker JC、Stossel TP 和 Weitz DA。由铰链细丝蛋白交联的预应力 F-肌动蛋白网络复制了细胞的机械特性。 过程。国家石油公司。学院派。科学。美国 2006; 103 (6):1762-7。[PMID:16446458 ]
- Chaudhuri O、Parekh SH 和 Fletcher DA。肌动蛋白网络的可逆应力软化。 自然 2007; 445 (7125) :295-8。[PMID:17230186 ]
- Katsumi A、Milanini J、Kiosses WB、del Pozo MA、Kaunas R、Chien S、Hahn KM 和 Schwartz MA。细胞张力对小 GTPase Rac 的影响。 J.细胞生物学。 2002; 158 (1):153-64。[PMID:12105187 ]
- 英格伯德。组织生长的机械控制:功能遵循形式。 过程。国家石油公司。学院派。科学。美国 2005; 102 (33):11571-2。[PMID:16091458 ]
- Zanotti G 和 Guerra C.张拉整体是蛋白质折叠的统一概念吗? FEBS 莱特。 2003; 534 (1-3):7-10。[PMID:12527354 ]
- 英格伯德。从宏观到微观的基于张拉整体的机械传感。 编。生物物理学。摩尔。生物学。 2008; 97 (2-3) :163-79。[PMID:18406455 ]
- 英格伯德。张拉整体:细胞力学转导的架构基础。 安努。生理学牧师。 1997; 59 :575-99。[PMID:9074778 ]
- 陈CS. 机械转导——一个拉在一起的领域? J.细胞。科学。 2008; 121 (弟 20 页):3285-92。[PMID:18843115 ]
- Chen CS、Alonso JL、Ostuni E、Whitesides GM 和 Ingber DE。细胞形状提供了对粘着斑组装的quan局控制。 生化。生物物理学。水库。交流。 2003; 307 (2) :355-61。[PMID:12859964 ]
- Polte TR、Eichler GS、Wang N 和 Ingber DE。细胞外基质通过调节细胞形状和细胞骨架预应力来控制肌球蛋白轻链磷酸化和细胞收缩性。 是。J.生理学,细胞生理学。 2004; 286 (3):C518-28。[PMID:14761883 ]
- Chen CS、Mrksich M、Huang S、Whitesides GM 和 Ingber DE。细胞生死的几何控制。 科学 1997; 276 (5317) :1425-8。[PMID:9162012 ]
- Curtis A 和 Wilkinson C.细胞行为的新深度:细胞对纳米形貌的反应。 生化。社会党。症状。 1999; 65 :15-26。[PMID:10320930 ]
- Cukierman E、Pankov R、Stevens DR 和 Yamada KM。将细胞基质粘附到三维。 科学 2001; 294 (5547) :1708-12。[PMID:11721053 ]
- Geiger B 和 Bershadsky A.探索邻域:粘附耦合细胞机械传感器。 细胞 2002; 110 (2):139-42。[PMID:12150922 ]
- Bershadsky AD、Balaban NQ 和 Geiger B.粘附依赖性细胞机械敏感性。 安努。牧师细胞开发。生物学。 2003; 19 :677-95。[PMID:14570586 ]
- Rumpler M、Woesz A、Dunlop JWC、van Dongen JT 和 Fratzl P.几何形状对三维组织生长的影响。 JR Soc 接口 2008; 5 (27) :1173-80。[PMID:18348957 ]
- Wang N、Butler JP 和 Ingber DE。跨细胞表面和通过细胞骨架的机械传导。 科学 1993; 260 (5111) :1124-7。[PMID:7684161 ]
- 吉莱斯皮 PG 和沃克 RG。机械感觉转导的分子基础。 自然 2001; 413 (6852):194-202。[PMID:11557988 ]
- 英格伯德。细胞机械转导:将部分重新组合在一起。 FASEB J. 2006; 20 (7) :811-27。[PMID:16675838 ]
- Hersel U、Dahmen C 和 Kessler H. RGD 改性聚合物:用于刺激细胞粘附等的生物材料。 生物材料 2003; 24 (24) :4385-415。[PMID:12922151 ]
- Silva GA、Czeisler C、Niece KL、Beniash E、Harrington DA、Kessler JA 和 Stupp SI。高表位密度纳米纤维对神经祖细胞的选择性分化。 科学 2004; 303 (5662):1352-5。[PMID:14739465 ]
- Engler AJ、Sen S、Sweeney HL 和 Discher DE。基质弹性指导干细胞谱系规范。 细胞 2006; 126 (4) :677-89。[PMID:16923388 ]
- Corbett SA 和施瓦茨鲍尔 JE。细胞外基质对蛋白质酪氨酸磷酸化的调节。 J.外科杂志。水库。 1997; 69 (1):220-5。[PMID:9202674 ]
- Wang N 和 Suo Z.细胞中力的长距离传播。 生化。生物物理学。水库。交流。 2005; 328 (4) :1133-8。[PMID:15707995 ]
世联博研(北京)科技有限公司一站式提供细胞应力加载培养仪(拉压流体剪切)、细胞力电偶联刺激与成像分析、高通细胞机械特性测试分析、cell confiner、单层细胞压力刺激加载与高分率成像分析、细胞自身力测试微柱阵列和96孔384孔板、组织材料微观各种力学特性测试分析、三维构建体刺激加载同时力测试分析、可力学刺激3D多器官仿真芯片系统、三维微重力超重失重模拟等设备,点击查看详细