Flipper-TR细胞膜张力荧光探针,Membrane Tension Probes,膜张力探针
型号:Flipper-TR
联系人:李先生
联系电话:18618101725
品牌:
Flipper-TR ® 是一个活细胞荧光膜张力探针,它打破了迄今为止只有生物物理学家使用定制设备才掌握的技术势所形成的技术壁垒。Flipper-TR膜张力探针通过使用标准荧光寿命测量简化了测定方法,这里我们更详细地介绍一下Flipper-TR的背景知识。
背景:
脂质膜是动态的流体结构(约4nm),这是实现生物学功能的必要条件,因为它们必须改变形状和张力,使细胞能够参与基本的细胞和亚细胞生理功能,如迁移、细胞扩散、吞噬、细胞分裂、内吞作用、机械传导和代谢等。因此,要实现这些功能膜张力会受到持续的调节,而膜张力又反过来调节细胞的生长、发育、运动、内吞和代谢。由于膜在这些细胞过程中被重塑,膜的弯曲、撕裂和拉伸是很常见的。膜形状和张力的空间和时间的变化是非常重要的测量参数,可以更好的帮助我们了解膜张力是如何被调节的,以及它如何调节这些基本的细胞过程。
膜张力测量通常依赖于低分辨率和缓慢的物理方法来测定压力和膜内张力。例如,测量膜张力的标准技术包括用夹在光学镊子中的珠子将膜管从质膜上拔出——这项技术有许多方法和技术上的限制。由于这些原因,研究者们迫切需要一种能够实时快速测量体内膜张力变化的新颖、灵敏、可靠、wu创的研究工具。
Flipper-TR®膜张力探针介绍:
荧光膜张力探针Flipper-TR®(Spirochrome, Ltd.)的面世解决了这些挑战,它可以搭配FLIM(荧光寿命成像显微镜)可以实现对活细胞膜的可视化染色。Flipper-TR®是一种活细胞荧光膜张力探针,是个为机械生物学领域开发的荧光膜张力探针。Flipper-TR®的荧光寿命与膜张力密切相关,利用FLIM可将不同寿命的荧光转换成不同的颜色显现出来,因此可以通过荧光和颜色及年度即可j确直观的测量膜内张力的时空分布。Flipper-TR®开辟了一个新的领域,它提供了一种灵敏、可靠和wu创的方法,通过这种方法可以快速、实时地测量活细胞的膜张力(图1)。
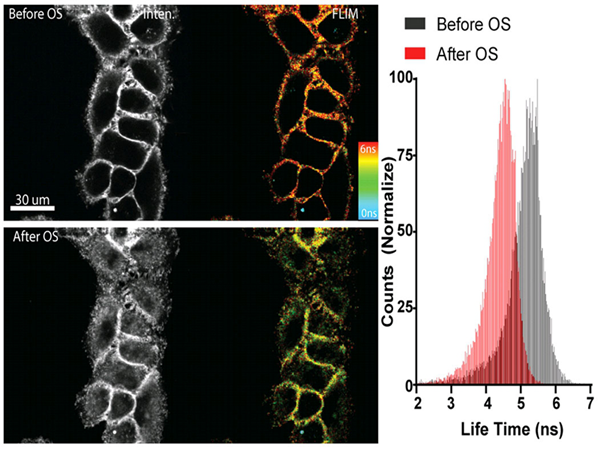
图1. Flipper-TR感知高渗休克处理后的细胞膜张力变化
左侧:与 Flipper -TR染色的细胞的图像® 高渗休克之前(上图)和后(下图)。
灰色程度代表荧光强度,不同颜色代表不同荧光寿命(蓝-红:0-6纳秒)
右侧:直方图显示高渗休克后的寿命变化,图片由Colom等人提供。
荧光Flipper -TR ®探针的工作原理是te异性地靶向细胞质膜,通过报告荧光寿命变化来反映膜张力变化情况。它是Flipper探针家族中的成员,它通过机械载体上的两个扭曲的二硫噻吩的扭转角和j化来感知脂质双层膜结构的变化。Flipper -TR ®自发插入到细胞的质膜中,只有插入到脂质膜中才会发出荧光,通过FLIM(荧光寿命成像显微镜)检测荧光的强度及颜色即可判断膜张力的大小,Flipper -TR ®探针具有广泛的吸收和发射光谱; 通常在488nm处进行激发,而发射光谱则在575和625nm之间(图2)。
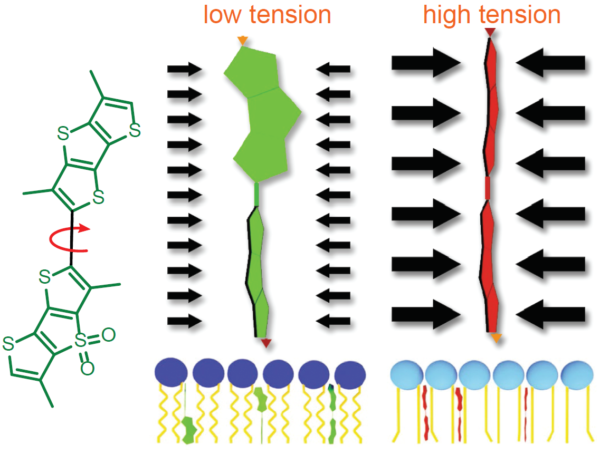
图2. Flipper-TR的工作原理及吸收/发射光谱
A.Flipper-TR机制及其与不同张力膜相互作用的示意图
左侧:Flipper-TR的基本分子结构
右侧:Flipper-TR在低张力扭曲(绿色)和高张力平行排列(红色)
B.对乙酸乙酯中的Flipper-TR溶液进行扫描和发射扫描,并将结果绘制在同一张图上。
点状橙色线激发光,实心橙色线为发射光。
染色和FLIM成像的详细步骤可以在参考文献中找到(点击了解)。
图3 . Flipper-TR在酵母细胞中的染色
Flipper-TR ® 适用于范围广泛的种属:包括细菌,哺乳动物, 植物和酵母。
对Flipper-TR染色的酵母细胞进行低渗透性choc(左)或高渗性choc(右)处理。
Flipper-TR的荧光寿命不同处理条件下高低变化,不同颜色表示不同的荧光寿命。
图片由UNIGE的Roux集团的M. Riggi提供。
Flipper -TR探针的常见问题解答®
FLIM显微镜称荧光寿命成像显微镜(Fluorescent Lifetime Imaging Microscopy)。膜张力研究的重要性在于,在Flipper-TR之前,膜张力测量需要耗费巨大的人力和昂贵的设备,但现在Flipper-TR却可以简单的适配当前显微镜来实现高灵敏度的张力测量,其设备可从许多供应商处获得,它原理是基于记录荧光团激发后发射的时间来反映膜张力的变化,其通常非常快,大约1-10纳秒(ns),在FLIM成像过程中,可将荧光寿命的差异通过时间来展示,一般来说,较短的寿命为绿色,中等寿命为黄色,较长的寿命为橙色和红色。FLIM还可以与其他高分辨率显微技术(如内反射荧光(TIRF)或受激发射耗尽(STED)显微镜)相结合,用于高空间分辨率检测。
FLIM显微镜需要配备许多科学显微镜供应商提供的时间分辨光检测器,例如PicoQuant的升级套件(https://www.picoquant.com/news/item/picoquants-flim-fcs-upgrade-kit-now-supports-zeiss -lsm780-and-leica-sp2),参考文献1描述了有关FLIM显微镜实验装置的更多细节。
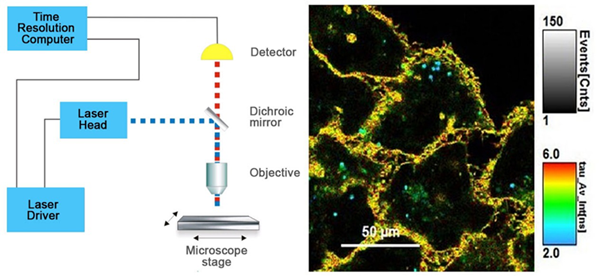
图4 . FLIM结构和时间分辨彩色编码细胞图像示意图。
左侧:标准FLIM显微镜结构图
右侧:Flipper -TR®染色的细胞 ,灰度表示荧光强度,不同颜色代表荧光寿命。
图片由Colom等人提供 Flipper-TR是瑞士Spirochrome SA的注册商标。
荧光Flipper-TR®探针通过te异性靶向细胞质膜,并通过其荧光寿命变化来反映膜张力变化。Flipper-TR®自发地插入细胞的质膜中,并且仅在插入脂质膜时才会激发荧光。探针通过机械载体上的两个扭曲的二硫噻吩之间的扭转角和j化改变来感知脂质双层膜结构的变化(参见图5)。当处于紧张状态时(二硫噻吩并排),发射寿命短(2-4ns),而在松弛状态下(二硫噻吩扭曲),发射寿命则更长(4.1-8.0ns)。方差(cv)约为0.3ns(cv = 4-15%),这允许在分辨率细微变化的情况下进行高分辨率分析,在FLIM成像过程中,可将荧光寿命的差异通过时间来展示,一般来说,较短的寿命为绿色,中等寿命为黄色,较长的寿命为橙色和红色(见图5)
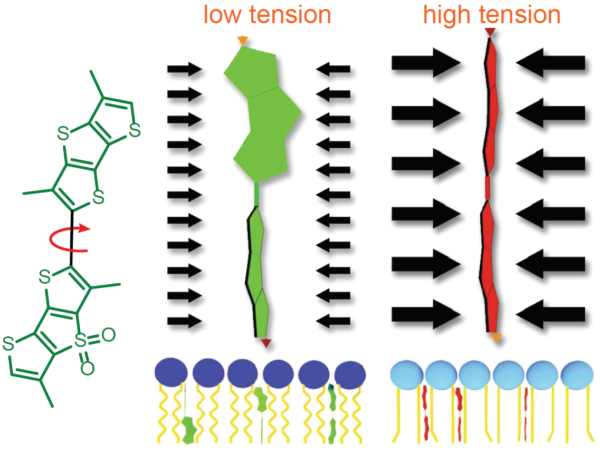
图5. Flipper-TR的结构和张力检测机制示意图
左边:Flipper-TR的基本分子结构
右边:Flipper-TR低张力时扭曲(绿色)和高张力时并列排布(红色)
Flipper-TR探针使用长分离滤光片组进行可视化,因为其激发峰值比发射峰值短100 nm以上。因此,里想的滤光片组是488 +/- 20nm的激发波长和575-675 +/- 40nm的发射波长(图3)。时间分辨测量方法允许非常低的背景,它在水性环境中具有低荧光,详情参见下面的问题4。
Flipper-TR探针在诸如组织培养基或固定缓冲液等水环境中的背景非常低,因为它是完扭曲的状态,容易形成胶束并自我淬灭(参考文献3)。插入膜后,其扭曲度变小,开始发出高荧光(见图2)。
探针在室温下以粉末形式稳定几天。在wu水DMSO中溶解后后(不要使用旧的打开过的DMSO瓶子,可以使用Sigma或Spectrum Chemicals的干燥DMSO瓶子。在-20°C下冷冻和解冻是稳定的,但不建议将其分成小份进行储存,因为它在这些条件下会降解。
在数据表中给定的条件下操作,探针对细胞wu毒的。根据细胞类型和培养条件,细胞一般可存活2-4天, 且荧光亮度不会有太大变化。
目前已知的生物都可用Flipper-TR染色,包括组织培养细胞,活的/固定的组织切片,哺乳动物细胞,昆虫细胞,植物细胞,酵母和细菌。
探针能够在3D培养条件下进行细胞染色。
乙酸乙酯中的量子产率= 0.30。
参考文献: