英国Kirkstall公司研发的Quasi Vivo流动培养系统,包括特别设计的培养小室、流动速度达到μL级高精度蠕动泵、封闭管路等组成。通过管路中培养基的流动,模拟血液剪切应力,为细胞提供更贴近体内的培养环境,使细胞增殖、分化、基因表达等更接近体内生理状态,缩短培养时间,提高研究效率。

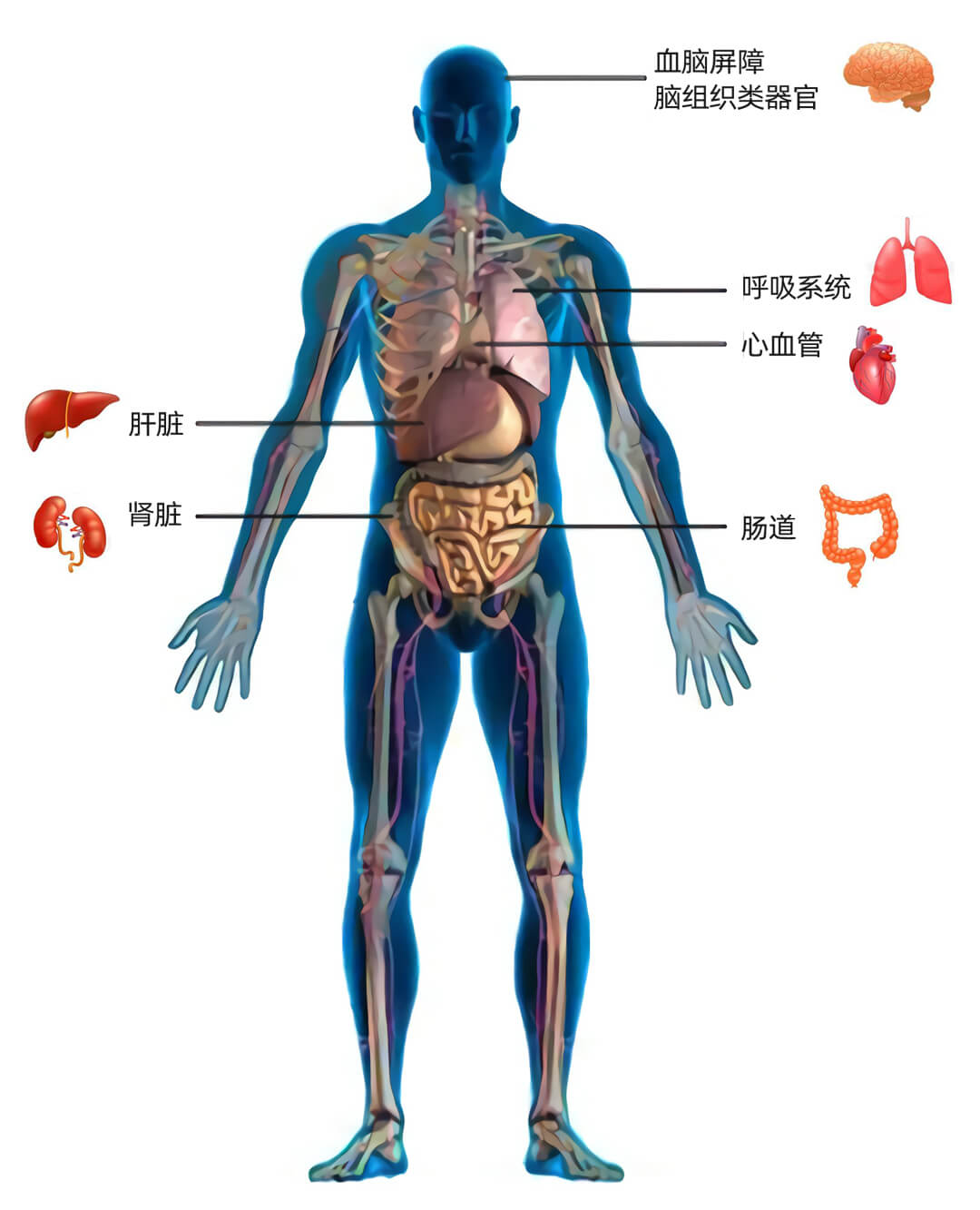
Quasi Vivo流动培养系统已在quan球70+个科研机构成功应用10年,已成功用于包括呼吸道上皮细胞、心血管、血脑屏障、肝脏、肾脏、肠道、糖尿病的研究中,并取得了可喜的研究成果。
目录
实例1. 促进呼吸道上皮细胞分化,缩短分化时间
实例2. 促进原代肝细胞培养中CYP450基因上调
实例3. 建立血脑屏障3种贴壁细胞共培养模型
实例4. 促进心肌细胞3D培养中产生血管结构
实例5. 研究糖尿病脂肪酸-葡萄糖代谢cross-talk
Quasi Vivo产品型号
Quasi Vivo参考文献
一、促进呼吸道上皮细胞分化
呼吸道上皮细胞的气液界面培养是研究经空气传播的病原体,如 SARS 等的常用的模型。传统的培养方式是用 TransWell 在普通培养箱中静置培养。但是此种培养方式wu法模拟培养过程中营养物质和代谢废物在组织内的运输,培养得到的模型通常有各种各样的缺陷,并且所需实验周期较长。而 Quasi Vivo 流动培养系统可为细胞培养提供持久恒定的流动培养环境,zui大限度模拟体内环境。研究发现,使用 Quasi Vivo 系统进行流动培养与静态培养相比,气液界面培养的呼吸道上皮细胞(正常人气管上皮细胞 Normal Human Bronchial Epithelial Cells,简称 NHBE;小气道上皮细胞 Small Airway Epithelial Cells,简称 SAE),发育分化速度更快,表现为纤毛分化度更高,纤毛运动更强、粘液产生和屏障功能更强。在灌注下加速分化后,将上皮细胞转移到静态条件下,并添加抗原呈递细胞(APC)以研究其在病原体感染后的功能。(Chandorkar P, et al., Fast-track development of an in vitro 3D lung/immune cell model to study Aspergillus infections. Sci Rep. 2017 7(1):11644. doi: 10.1038/s41598-017-11271-4.)
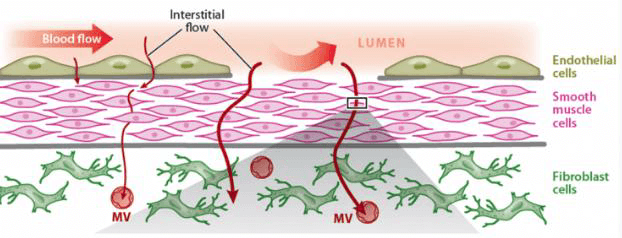
图 1. 人体内的细胞都需要营养物质和代谢废物的流动
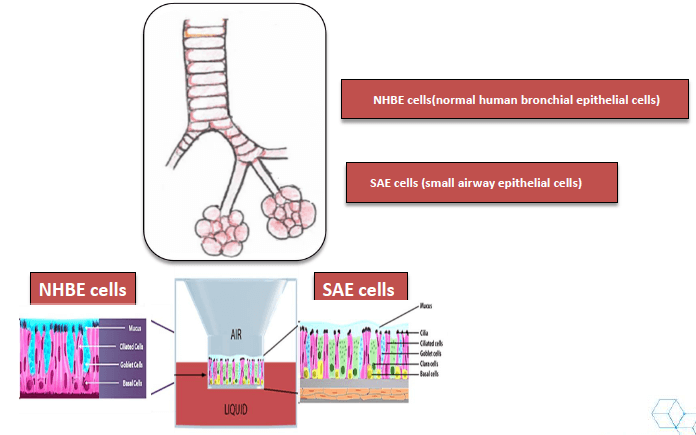
图 2. 肺部气管/支气管和小气道上皮结构精细,进行体外培养模拟体内环境,对呼吸道病原体的研究至关重要。

图 3. 呼吸道上皮细胞的常规 transwell 静止培养方式
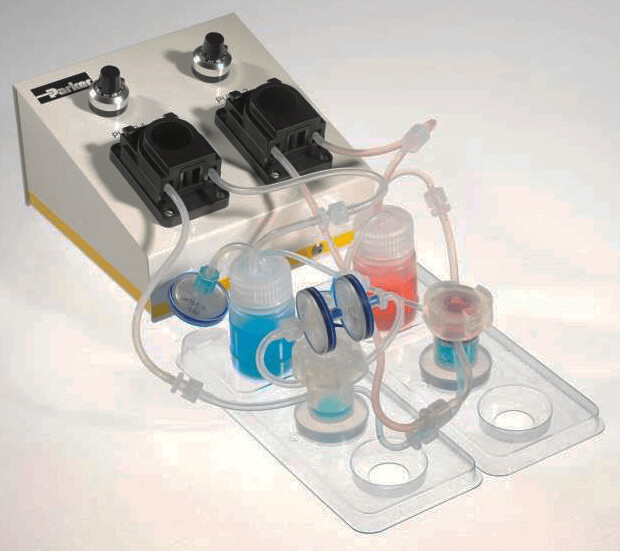
Quais Vivo(QV600)流动培养系统(含腔室+储液瓶+底座+管道 )


图 4. 采用的流动培养方式培养呼吸道上皮细胞(采用 QV600)
有研究显示,使用 transwell 静止培养(Static Condons)和Quasi Vivo流动培养系统(Perfused Condons),呼吸道上皮细胞的生长和分化呈现更好状态:

图5 电镜照片显示,采用流动培养方式(Perfused condons)的呼吸道上皮细胞,分化程度更高。
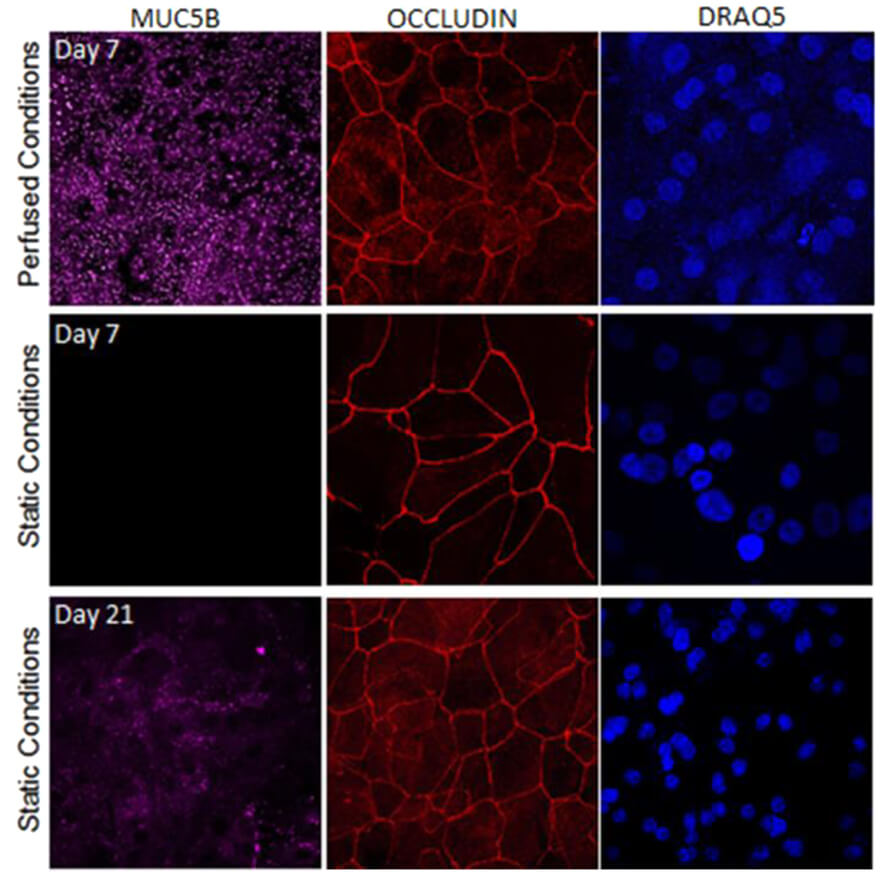
图 6 使用 MUC5B 染色可以发现,采用流动培养方式(Perfused condons)的呼吸道上皮细胞,在培养的弟7天即可分泌大量粘液。用 OCCLUDIN 染色可以发现,细胞间的紧密连接发育更完善。
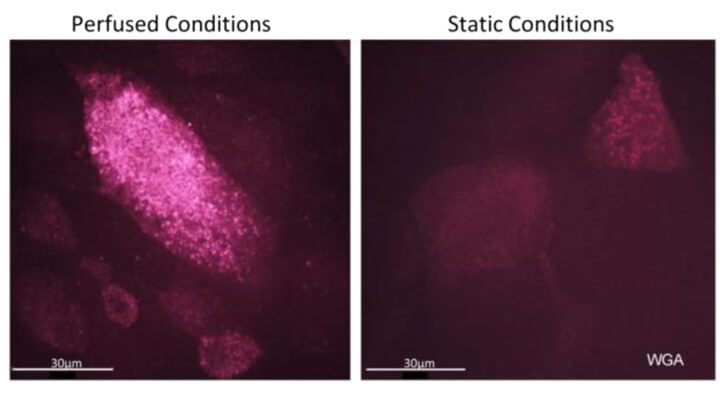
图 7. 使用 WGA 染色发现,采用流动培养方式(Perfused condons)的呼吸道上皮细胞,纤毛分化度更高
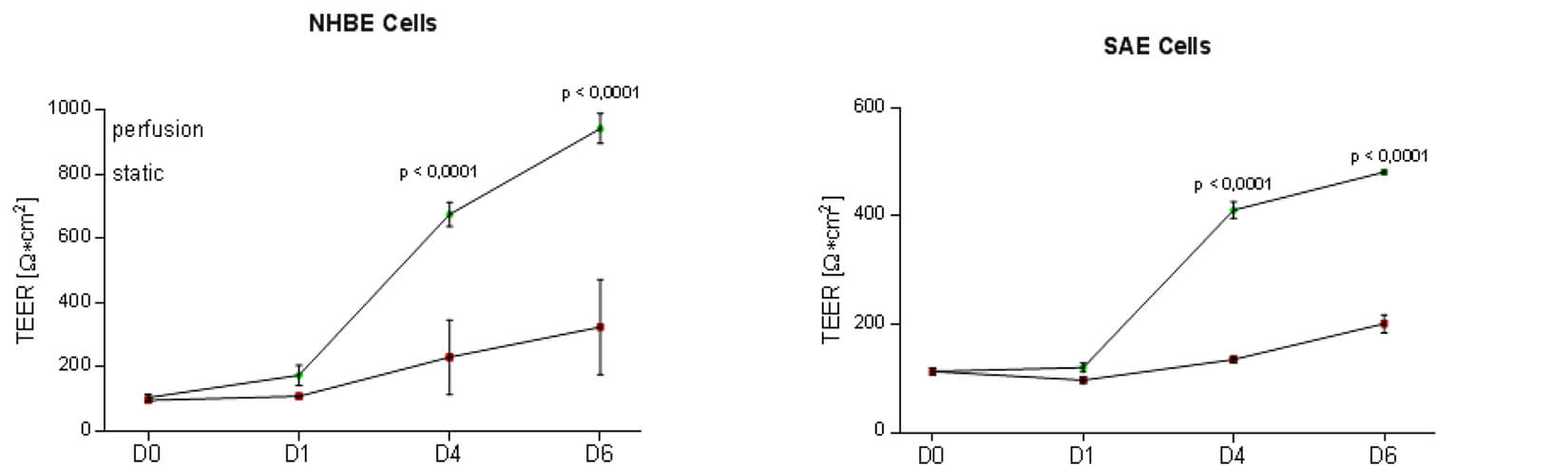
图 8. 测量 TEER(经细胞电阻),采用流动培养方式(Perfused condons)的呼吸道上皮细胞 TEER 值更大,代表得到的上皮细胞膜状结构更完整。
二、促进原代肝细胞培养中CYP450基因上调
鉴于人肝细胞原代培养在药物代谢、毒性、副作用的研究中被视为核心检验标准,而原代培养的肝细胞经常面临诸如解毒基因表达量下调的问题(如膜转运蛋白、结合酶、细胞色素 P45),在Vinci B 等人的肝细胞研究中(Vinci B, et al. Modular bioreactor for primary human hepatocyte culture: medium flow stimulates expression and activity of detoxification genes. Biotechnol J. 2011; 6: 554-64),认为正是传统静置培养wu法模拟的某些生理刺激,引发了基因表达的下调。而 Vinci B 通过 Quasi Vivo 流动培养人原代肝脏细胞后,不论基因表达量、酶活还是生物参数,均证明流动培养可特异性地上调多种解毒酶基因的表达,而且流动培养的人贴壁肝细胞,其解毒酶基因家族的表达水平接近或高于新鲜分离的肝脏细胞。
实验流程
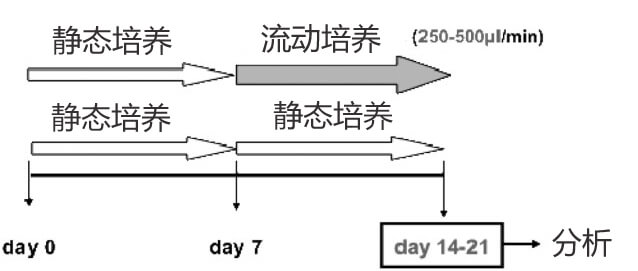
1、将原代肝细胞进行静态培养,在弟七天分组,一组保持静态培养,一组改为 Quasi Vivo 流动培养,继续培养至二十一天,进行检测。
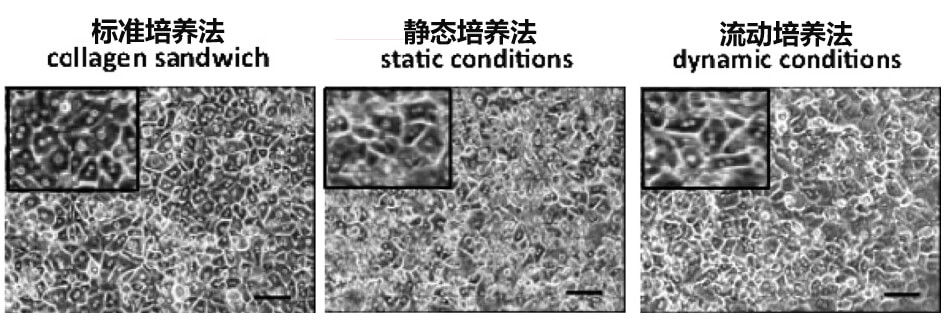
2、分别进行流动培养、静态培养、标准培养十四天后的肝脏细胞(FT297),形态wu差异。
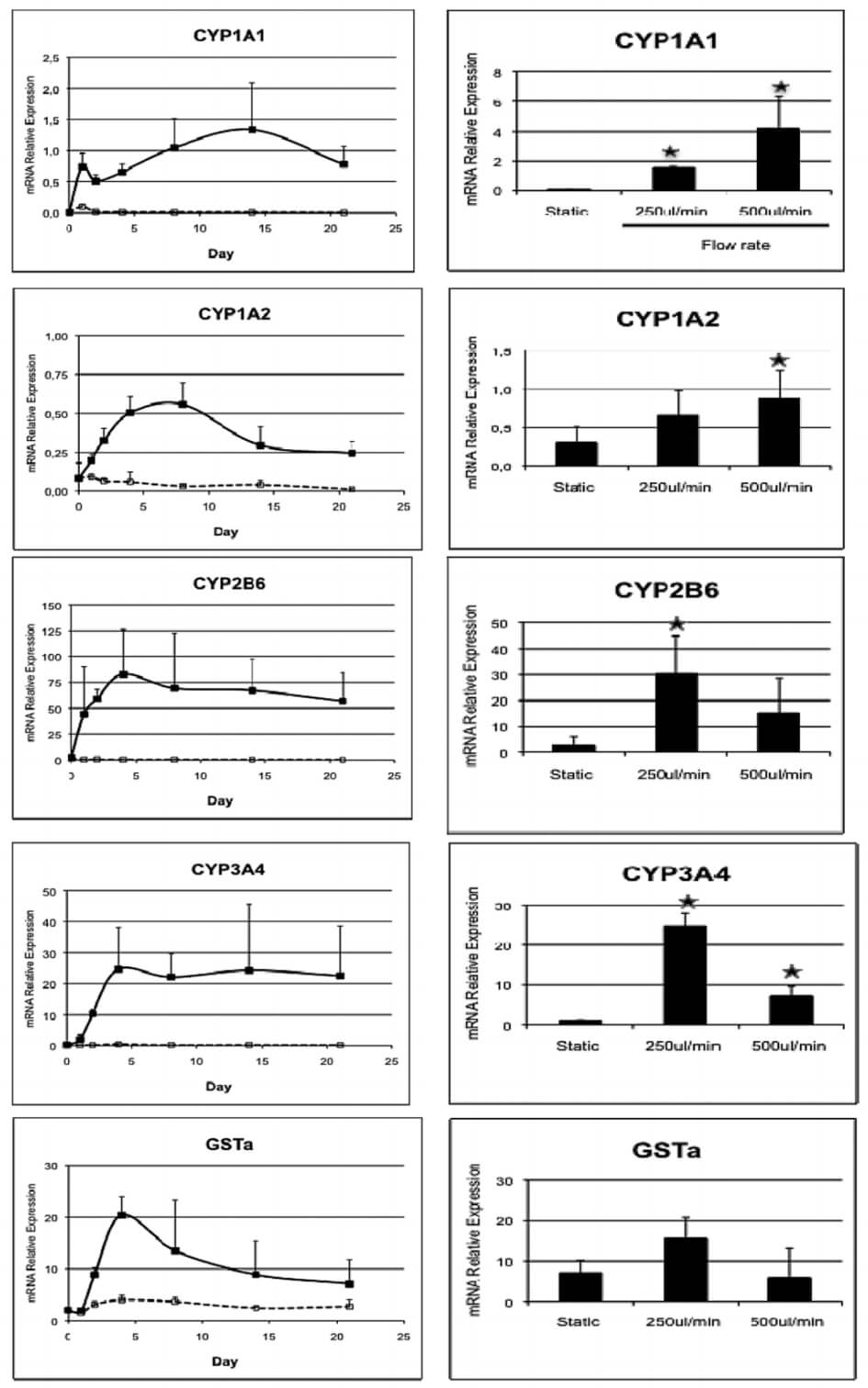
3、流动培养下的肝细胞 CYP1A1、CYP1A2、CYP2B6、CYP3A4、GSTa 等解毒酶基因表达更高,到达峰值时长有差异。
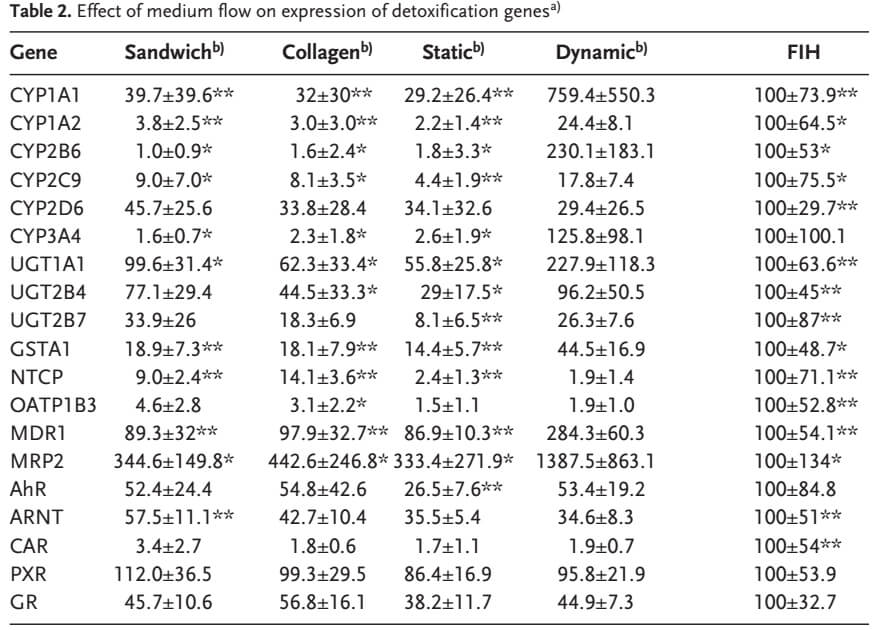
4、多种解毒基因上调,CYP1A1 等基因表达甚至高于新鲜分离的肝脏细胞(FIH)。
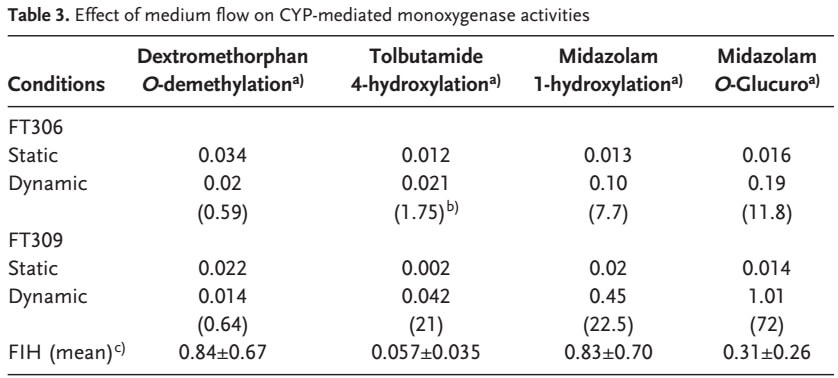
5、流动培养提高了肝脏细胞 CYP3A4、UGT2B4/7、CYP2C9 的活性,化合物代谢速率显著提高。
文章小结:
1、人原代肝脏细胞分别进行 7-21 天的流动培养、静态培养;
2、检测肝脏细胞 32 个基因的表达量、酶活和生物参数;
3、使用流动培养可提高人贴壁肝脏细胞解毒基因表达:
①UGT(尿苷二磷酸葡萄糖醛酸转移酶)基因家族表达上调:UGT1A1/UGT2B4/UGT2B7;
②多药耐药相关蛋白 1 (MDR1)和 MRP2 基因的 mRNA 的表达上调;
③外源物质/药物代谢和运输基因表达上调,并激活某些酶活性:CYP1A1/1A2/2B6/2C9/3A4;
④GST(谷胱甘肽 S-转移酶)基因表达上调。
三、建立血脑屏障3种贴壁细胞共培养模型
血脑屏障(blood-brain barrier, BBB)在中枢神经系统(CNS)的生理和病理中都起着重要的作用。血脑屏障功能异常会引起包括阿尔茨海默症(AD)等许多神经退行性疾病。组成血脑屏障的毛细血管内皮细胞(capillary endothelial cells)、周细胞(pericytes)以及星形胶质细胞(astrocytes)间的复杂的相互作用使得很难在体内确定这三种细胞对神经毒性各自的贡献。而 Quasi Vivo 流动培养系统可为体外培养这三种细胞提供在不形成屏障的情况下维持细胞间通讯的zui佳培养环境。Quasi Vivo 流动培养系统为未来研究不同类型的血脑屏障细胞在中枢神经系统疾病和细胞毒性试验中的特殊作用提供一个有价值的工具。(Miranda-Azpiazu P, et al. A novel dynamic multicellular co-culture system for studying individual blood-brain barrier cell types in brain diseases and cytotoxicity testing. Sci Rep. 2018; 8(1): 1-10.)
图 1. 单du培养的人星形胶质细胞(A,GFAP 阳性)、周细胞(B,α-actin 阳性)、血管内皮细胞(C,CD31 阳性)以及血管内皮细胞形成的紧密连接(D,ZO1 阳性)。
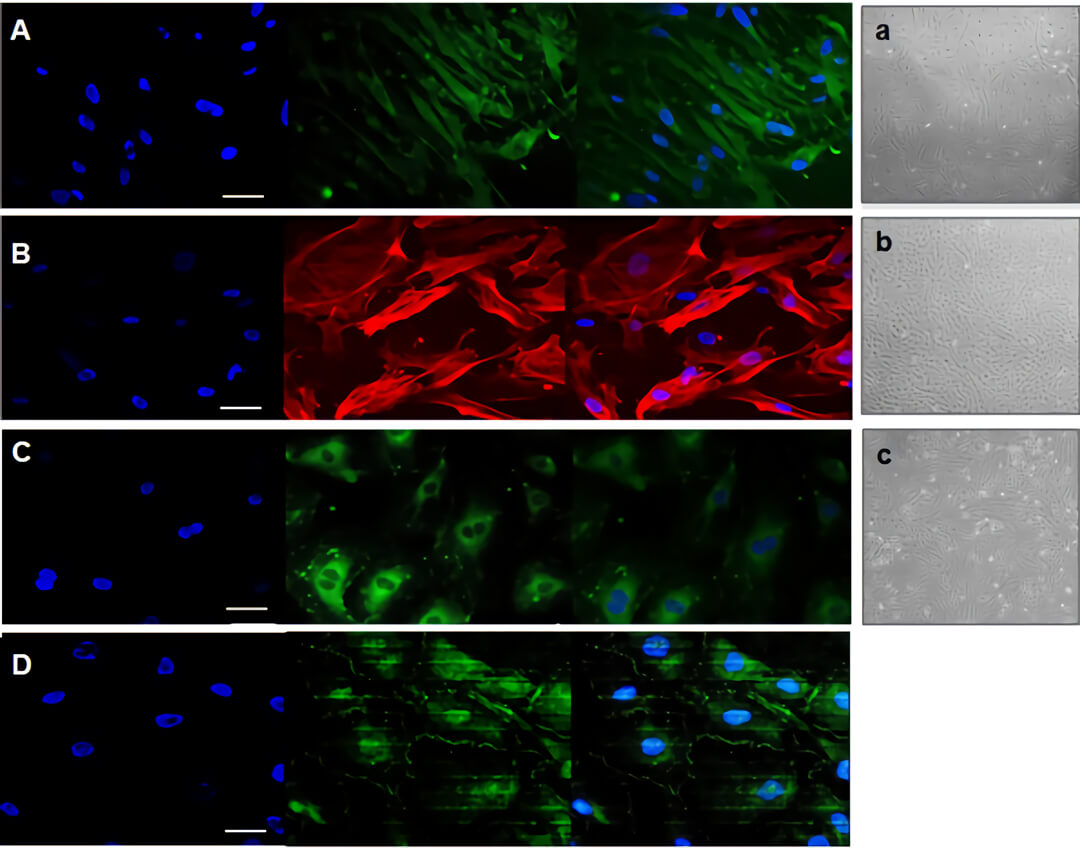
图 2 用 Quasi-Vivo QV500 培养共享相同的培养基的星形胶质细胞、周细胞和血管内皮细胞的示意图(A),R 为储液瓶,P 为蠕动泵。连接培养基存储瓶的一个 Quasi-Vivo QV500 流动培养系统的细胞培养腔室(B)。
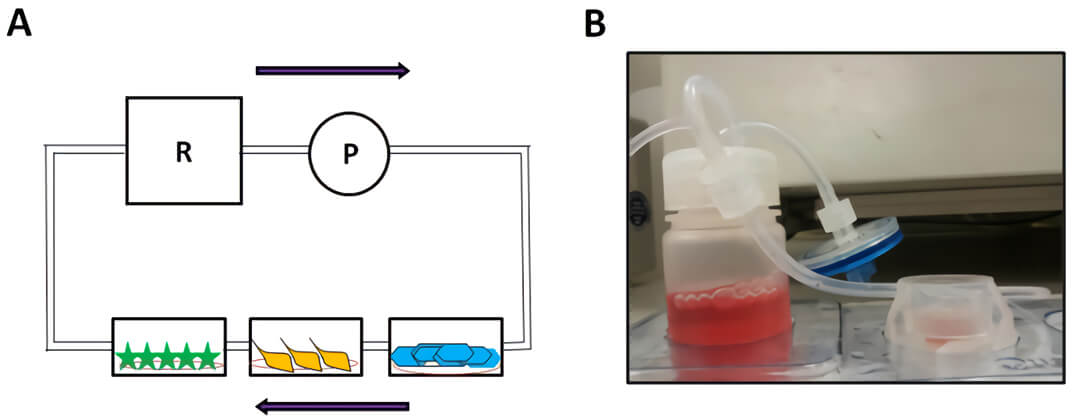
图 3 Quasi-Vivo QV500 流动培养系统建立的能同时培养三种不同细胞的多细胞共培养体系。
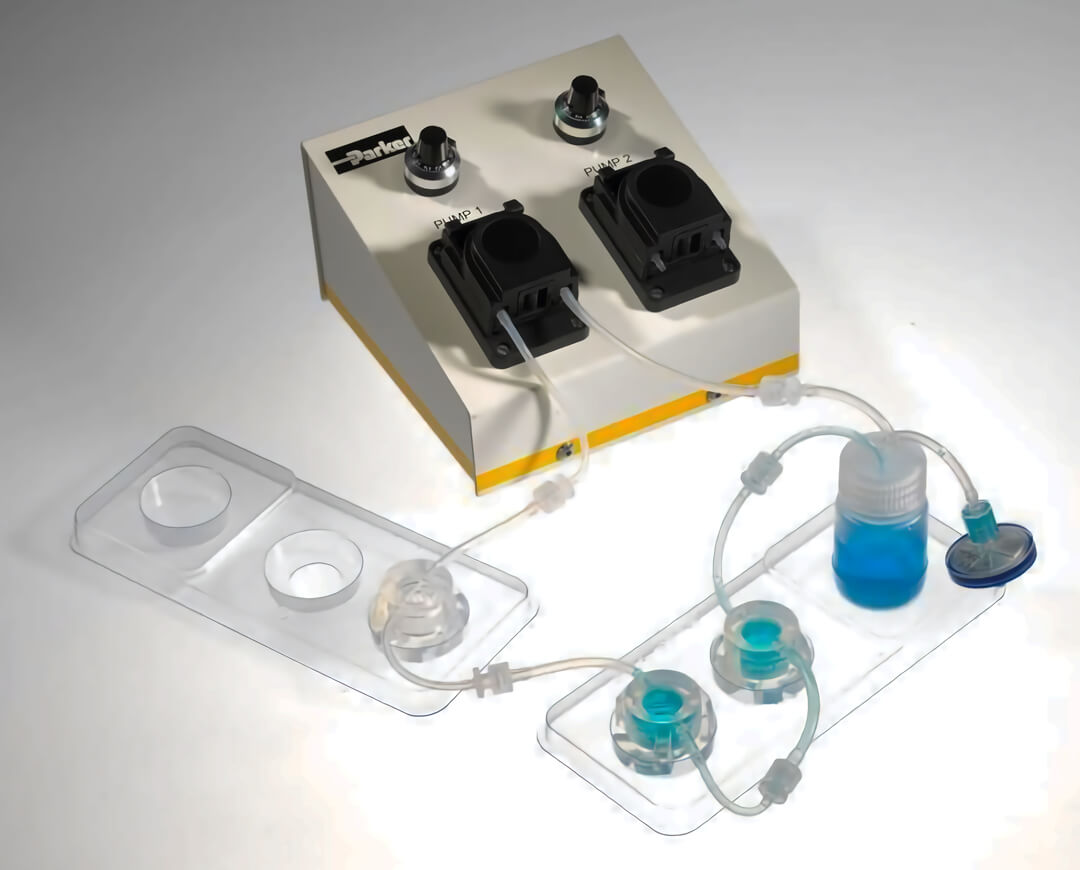
图 4 几种流动培养方式示意图:A 图为单du星形角质细胞流动培养,B 图为单du周细胞流动培养,C 图为单du血管内皮细胞流动培养,D 图为三种细胞组合后一起流动培养。
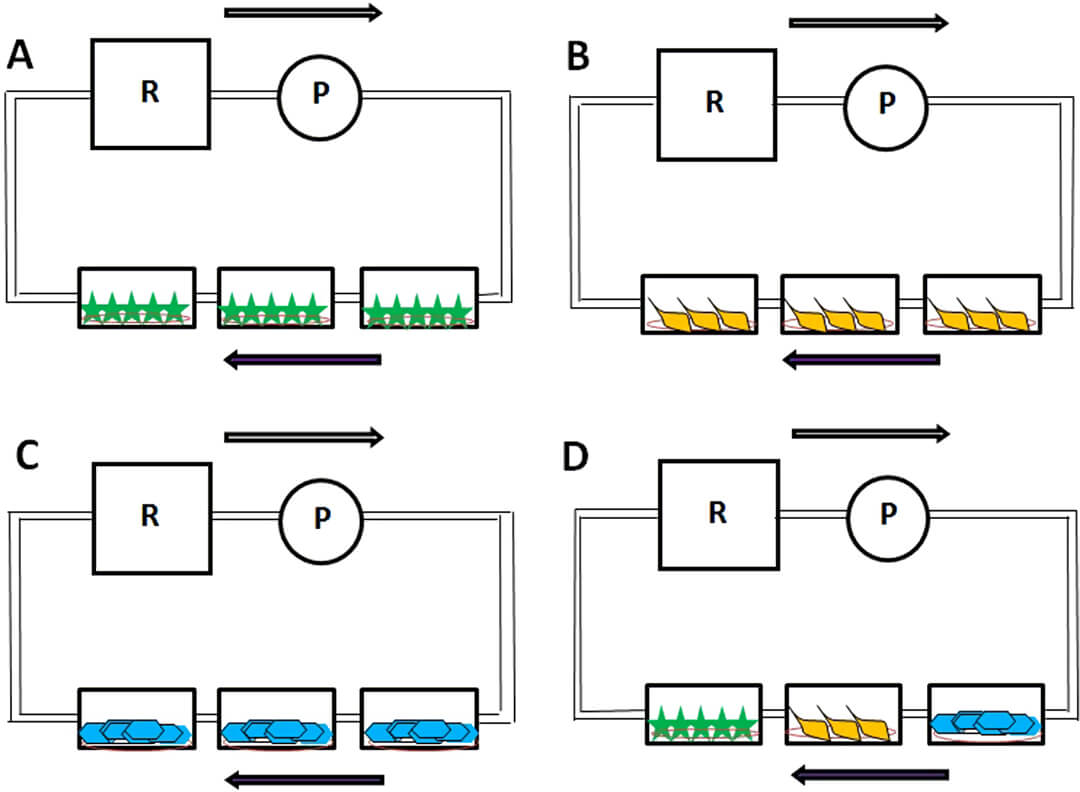
图 5 用 MTT 法测细胞活力,与静态培养相比,采用 Quasi-Vivo QV500 流动培养系统对单du培养血管内皮细胞(HBECs)、周细胞(HBVPs)、星形角质细胞(HAs)(A)或三种细胞共培养(B)的血管内皮细胞的细胞活力有明显升高。
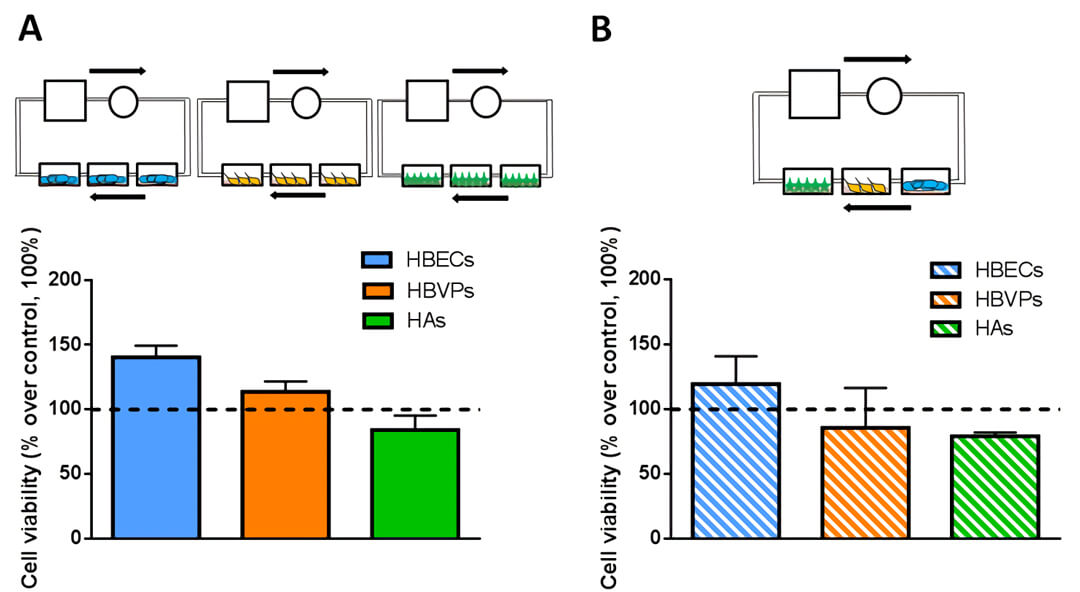
图 6 用 MTT 法测细胞活力,与静态培养(Static)相比,流动培养(Dynamic)的周细胞(HBVPs)会更早受到 Aβ25-35(淀粉样蛋白 β 肽的 Aβ25-35 片段,用于阿尔茨海默病的造模)的毒害。
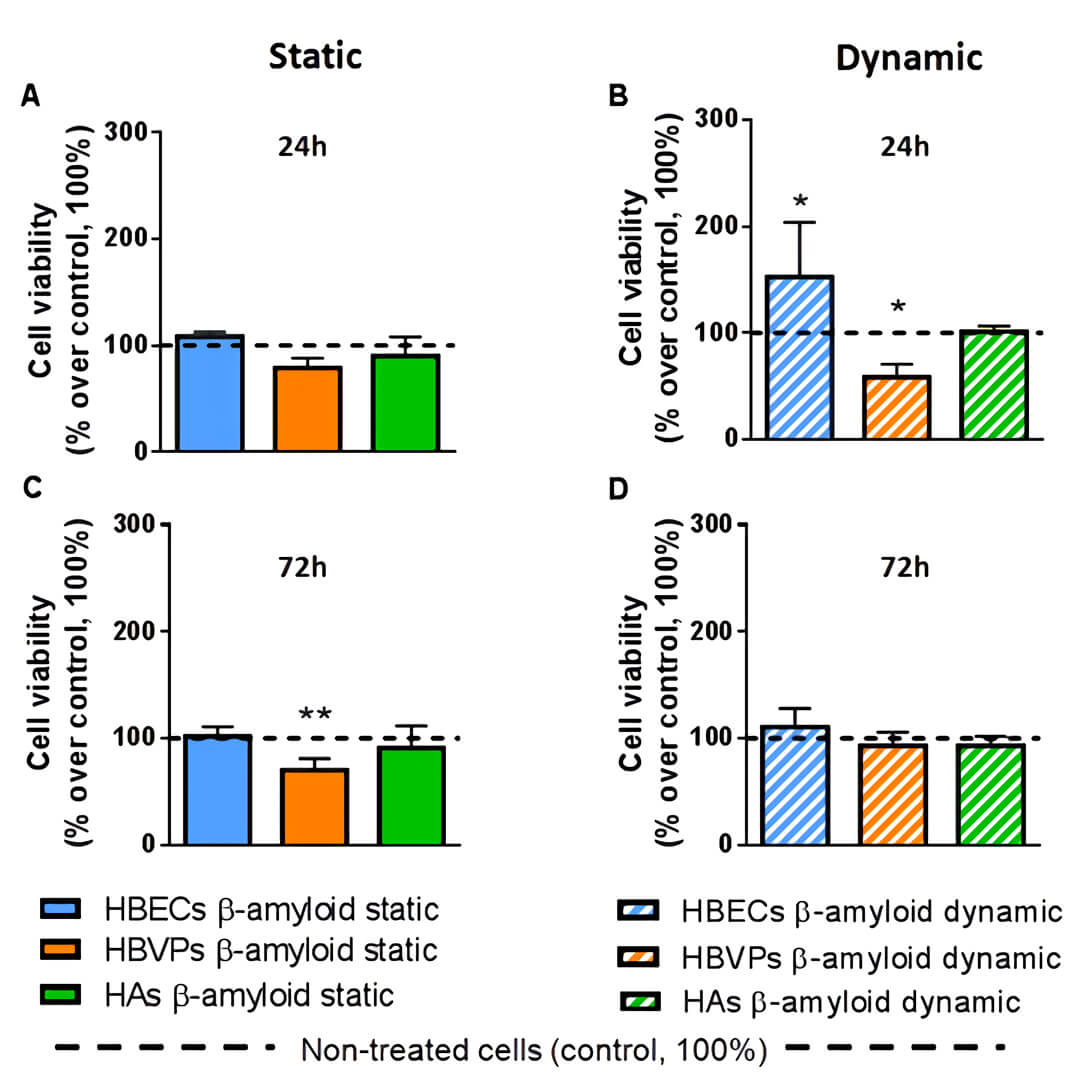
总结:本文中研究者利用 Quasi-Vivo QV500 流动培养系统建立了三种细胞的共培养。这些细胞不接触,通过共享培养基实现细胞间的通信,不形成屏障能更好的研究这些细胞类型单du对不同化合物的响应情况。并且研究者还发现共享相同培养基的星形胶质细胞、周细胞和血管内皮细胞的zui适流速为 50 l/min。
在再生医学领域,怎样培养出含血管的组织,是未来应用能否成功的关键之一。早期的临床试验采用生长因子或细胞注射的方法来修补损伤的心脏,但由于注射细胞造成的炎症反应和局部缺血会在体内造成低氧环境,使得注射的细胞定植率低而死亡率高,不能有效地修复损伤的心脏功能。
QV500 流动培养系统为接种在明胶支架上的人间充质干细胞(hMSCs)和人心肌祖细胞(hCMPC)提供充足的氧气,促进细胞和营养物质向支架核心内扩散,并能快速有效地排除组织内的代谢废物,促进血管生成,从而形成由血管样和心脏样细胞组成的组织结构密集的适于体内移植的原组织。(Pagliari S, et al. A multistep procedure to prepare pre-vascularized cardiac tissue constructs using adult stem cells, dynamic cell cultures, and porous scaffolds. Frontiers in Physiology. 2014; 5: 210)

图 1. Quasi-Vivo 流动培养系统 (QV500 型)的蠕动泵将培养基从储液瓶泵到两个串联的培养腔室内,并能保持恒定流速(200μl/min),保证多孔明胶支架内层的培养基流动。
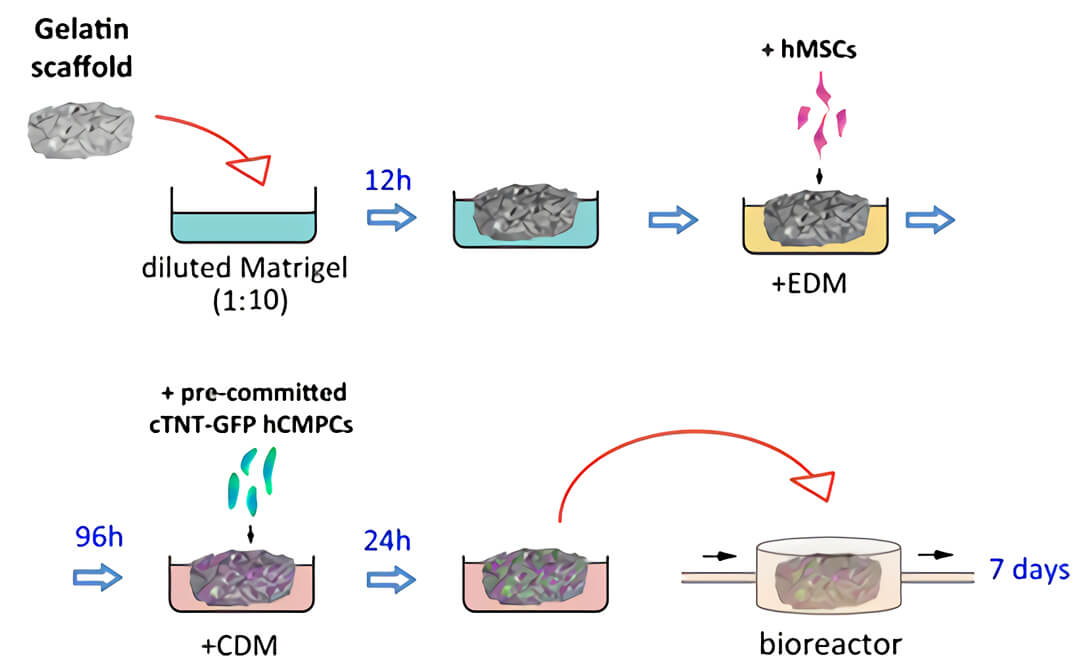
图 2. 构建含血管的 3D 心脏的实验方案示意图。明胶多孔支架(Gelatin scaffold)被浸入稀释的Matrigel中,然后转移至内皮分化培养基(EDM)中。之后将人间充质干细胞(hMSCs)接种在支架上,使人间充质干细胞定殖在支架培养上并向内皮进行分化,96 小时后,将在聚苯乙希细胞培养板用心脏分化培养基(CDM)预先定型 2 周的心脏 GFP 人心肌祖细胞接种于血管化的支架上,用 QV500 流动培养系统在心脏分化培养基中培养 7 天。

图 3. 采用图 2 的实验方案,对用 QV500 培养一周后的共培养结构进行检测,发现在支架上有大量细胞定殖。
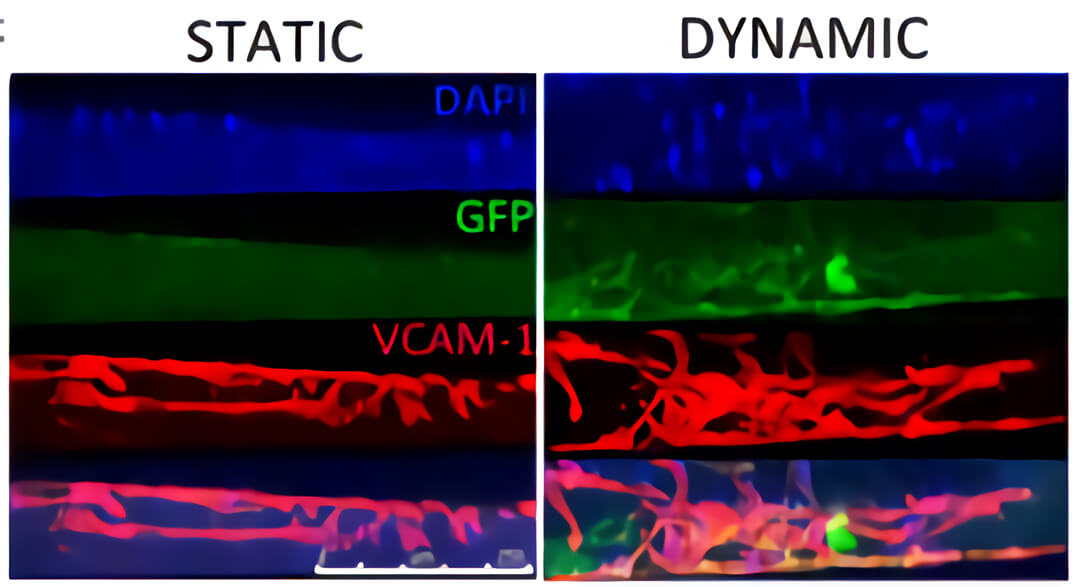
图 4. QV500 流动培养条件下(DYNAMIC)支架内部浸润了大量的血管样细胞(红色)和人心肌前体细胞(hCMPC)衍生的心肌细胞(绿色),而静态培养条件下(STATIC),细胞大部分分布在支架表面。
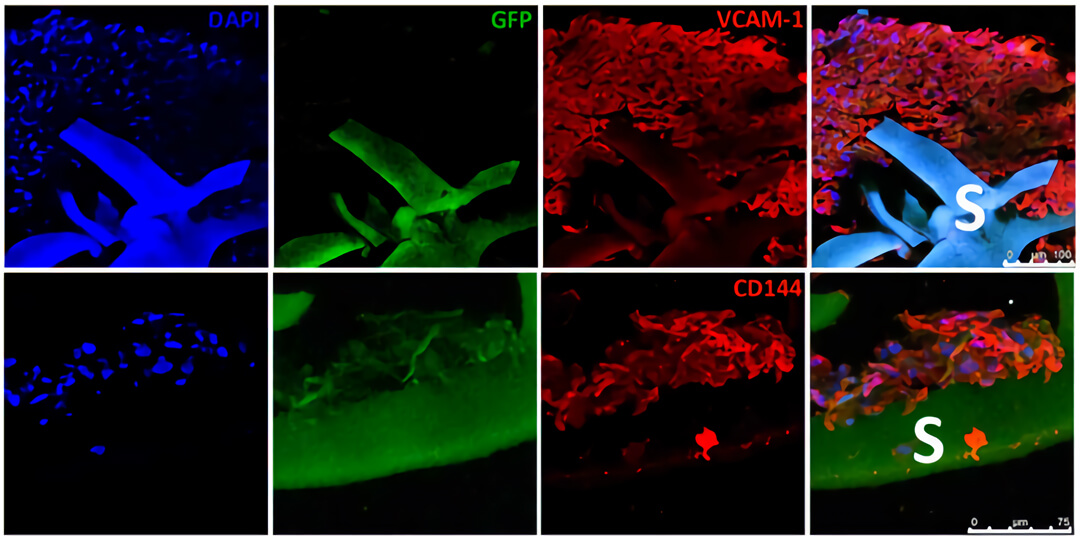
图 5. 免疫组化结果显示通过 QV500 动态培养可以促进心肌样细胞(GFP,绿色)和内皮样细胞(VCAM-1 阳性细胞,红色)向支架内部浸润。

图 6. (A) 切片显示 QV500 流动培养的内皮样细胞(VCAM-1阳性细胞,红色)排列成孔状,形成管状结构,并与心肌样细胞(GFP,绿色)接触。(B)QV500 流动培养条件下,支架内广泛的细胞分布导致形成密集组装的多细胞组织,该组织衍生自所用的人间充质干细胞(hMSCs)和人心肌前体细胞(hCMPC)。
总结:在本文中使用的 QV500 流动培养系统,能增强氧气与营养物质的运输,进而增强工程化心血管组织的活性和功能。
五、研究糖尿病脂肪酸-葡萄糖代谢cross-talk
营养过剩表现为代谢谱的变化和胰岛素敏感度的损伤。早期以静态培养方式为基础的体外研究只能提供单个细胞中单分子途径的大量信息,尽管已经在局部细胞水平上对稳态、炎症和损伤的信号传导机制进行了充分的研究,但不能用于研究单个细胞或组织的变化信号是如何传达给身体的其他部位,不同组织之间的 cross-talk 如何决定quan身代谢水平。
以 QV500 流动细胞培养为基础建立的三维脂肪组织+内皮细胞+肝细胞(AT+EC+HEP)流动培养法通过培养基的流动经串联培养室连接起来,以模拟血液连接身体中的不同组织或器官。
此流动培养模型通过为细胞及时补充营养物质、增加供氧量,并且还能为细胞提供由培养基的流动和细胞的 crosstalk 产生的间质样剪切应力来维持高的细胞活力,在体外系统地重建内源代谢,是研究不同位置的许多关键器官的具体功能和如何通过器官之间的相互作用来维持quan身能量平衡的有力工具。(Iori, E., et al. Glucose and Fatty Acid Metabolism in a 3 Tissue In-Vitro Model Challenged with Normo- and Hyperglycaemia. PLoS ONE. 2012; 7: e34704; Vozzi, F., et al. A flexible bioreactor system for constructing in vitro tissue and organ models. Biotechnol Bioeng. 2011; 108: 2129–2140)
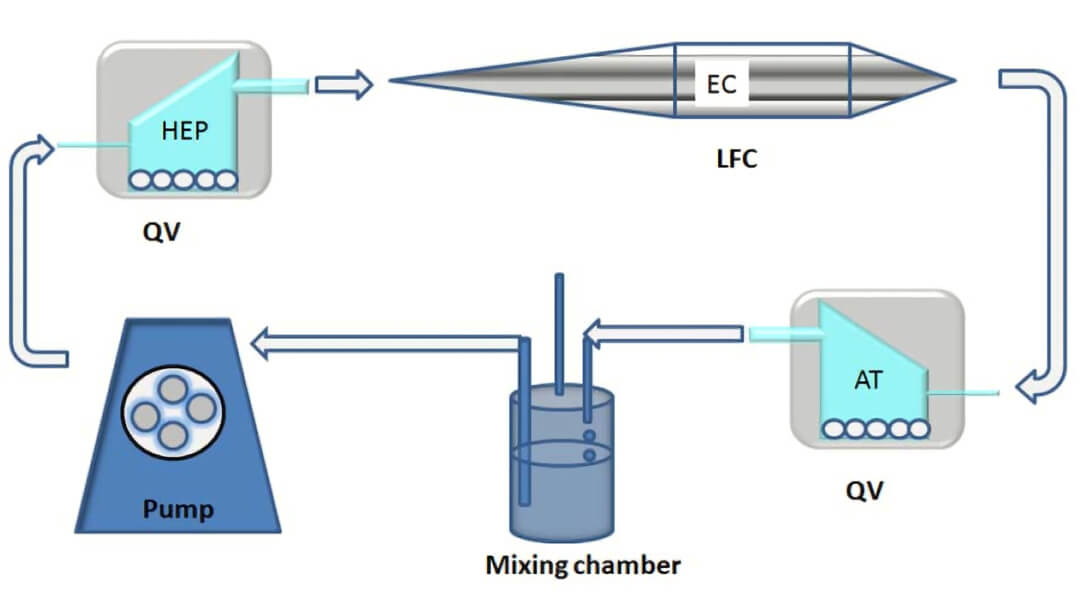
图 1 三维脂肪组织+内皮细胞+肝细胞(AT+EC+HEP)流动培养法的示意图。Quasi Vivo 生物反应器 (QV500) 培养肝细胞和脂肪组织用低剪切的培养室,而用于内皮细胞的层流室(LFC)采用的是高剪切。
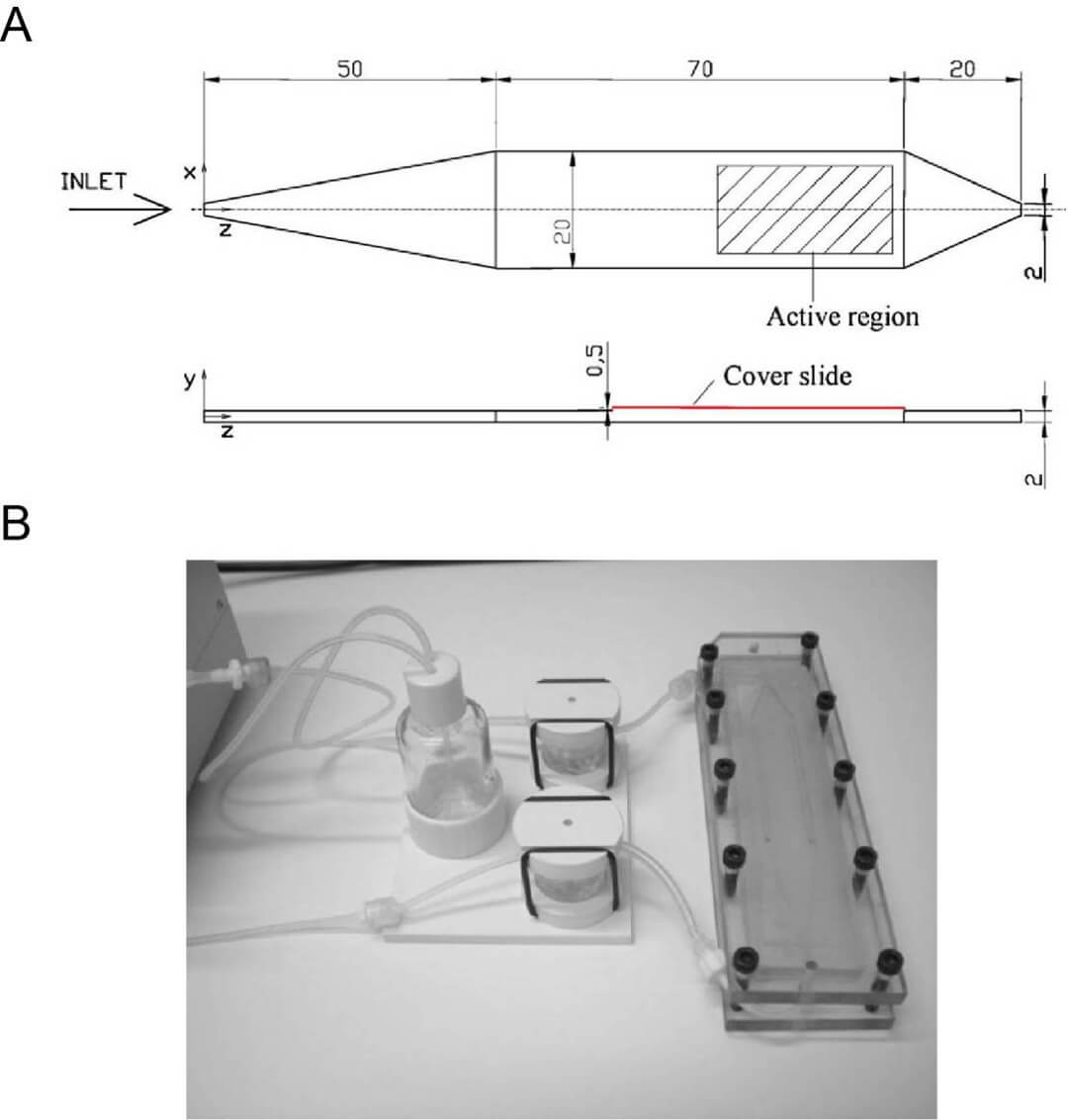
图 2. 内皮细胞培养用的高剪切层流室(LFC)(A) LFC 设计图。(B)组装入流动培养反应器中的 LFC, 本图中采用的是 Quasi Vivo 流动培养系统的原型机(Vozzi, 2011)。
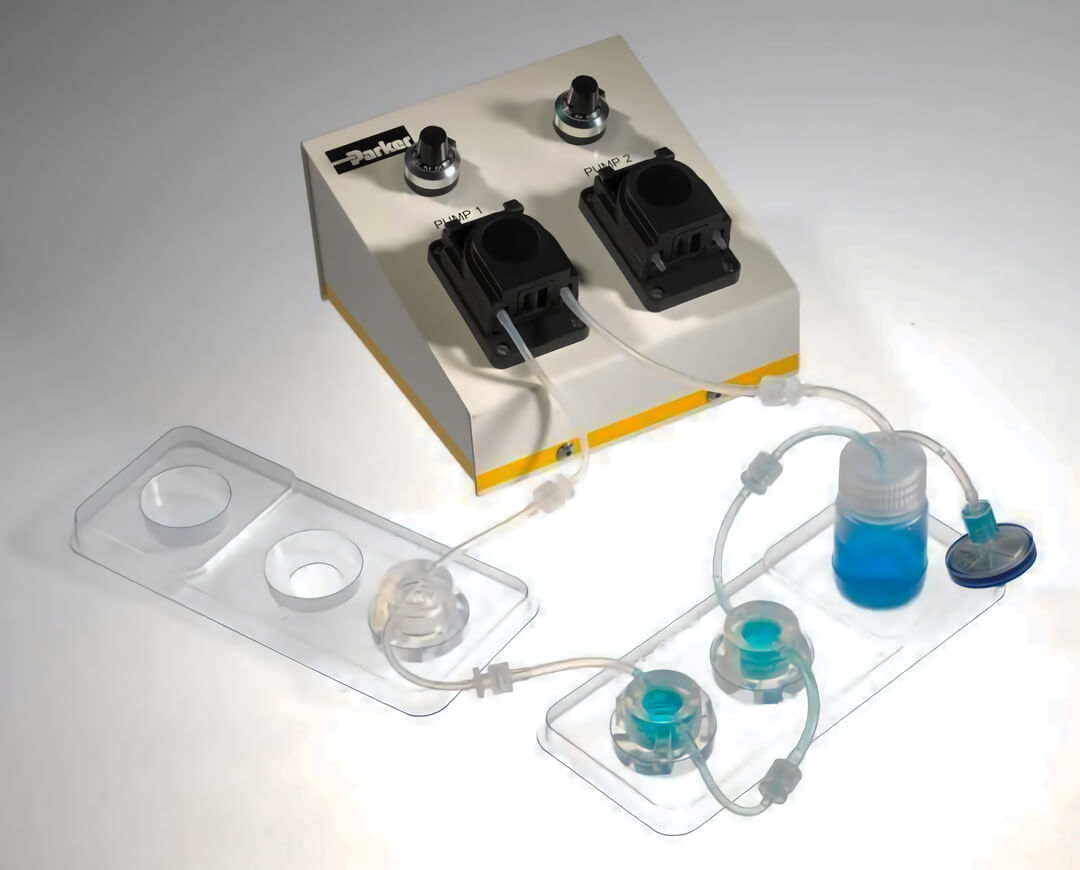
图 3. 目前商品化的 QV500 流动培养系统操作更简单,使用更方便。适合低通量的实验。
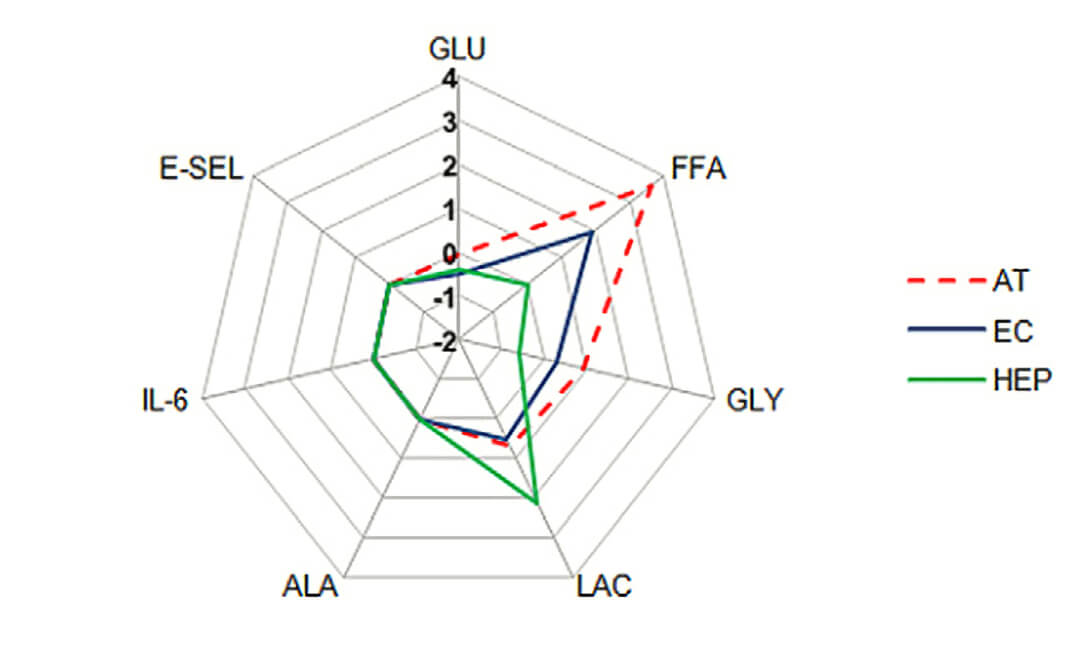
图 4. 流动培养的三维-脂肪组织+内皮细胞+肝细胞(AT+EC+HEP)能更好的维持代谢物的稳态平衡。与二维-脂肪组织+内皮细胞(AT+EC)相比,流动培养的三维-脂肪组织+内皮细胞+肝细胞(AT+EC+HEP)的葡萄糖,甘油和游离脂肪酸的水平在 48 h 内没有变化,而白蛋白的合成以及乳酸和 L- 丙氨酸的释放有所增加。GLU(葡萄糖),GLY(甘油),LAC(乳酸盐),ALA(L- 丙氨酸),E-SEL(E- 选择素)FFA(游离脂肪酸)。
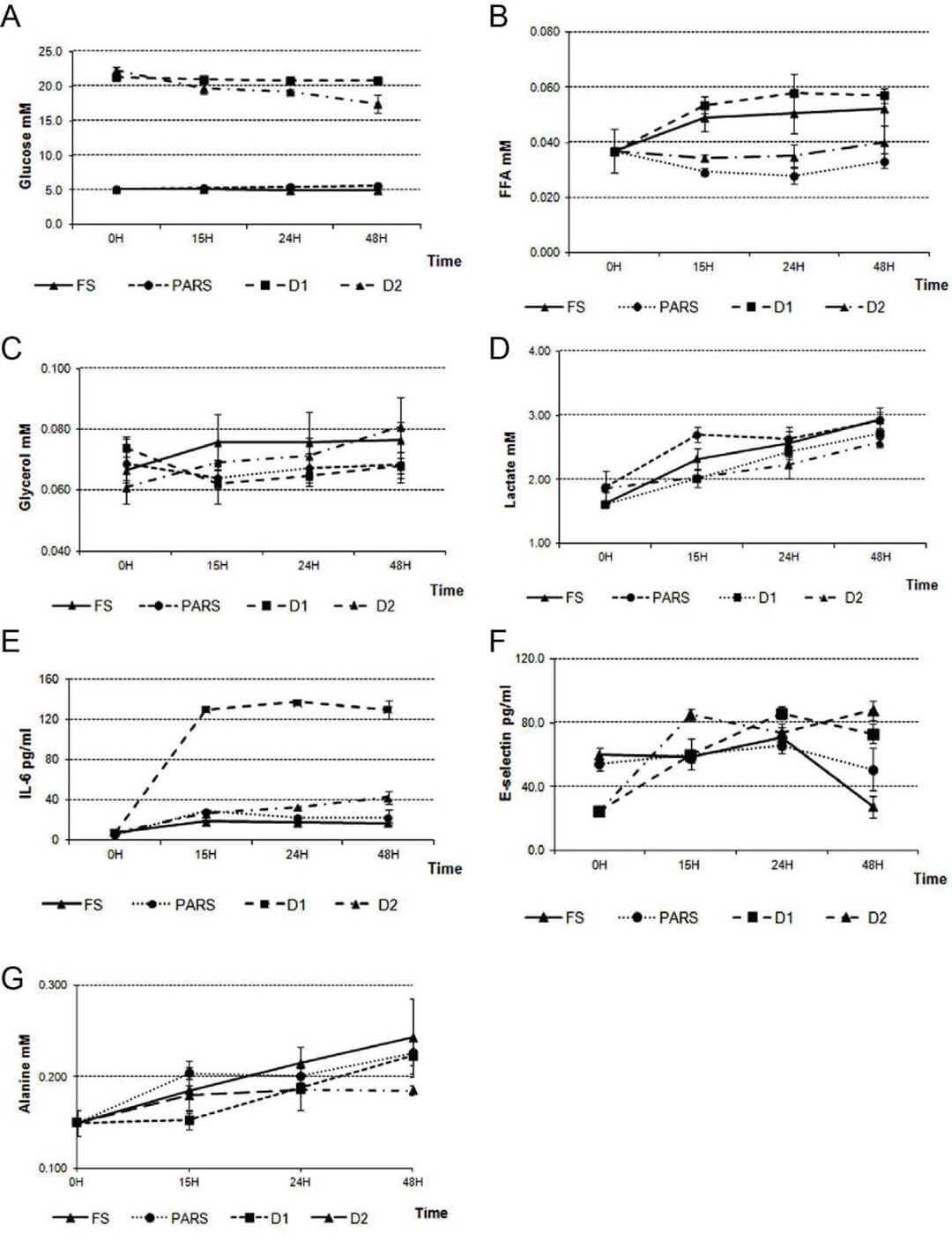
图 5 Quasi Vivo 流动培养系统可以轻松取出旧培养基进行分析或补充新的培养基,在不同条件下进行长期实验而不会干扰细胞。适合同一细胞样品的多时间点连续取样。
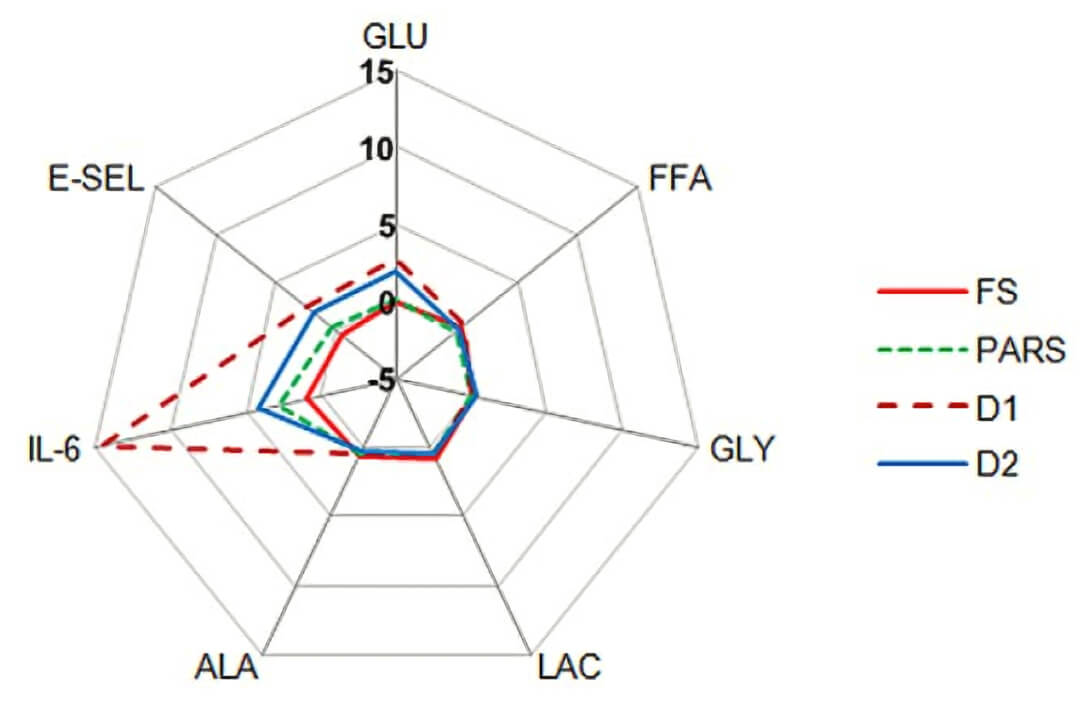
图 6.流动培养的三维-脂肪组织+内皮细胞+肝细胞(AT+EC+HEP)模型能充分揭示葡萄糖过量和胰岛素不足导致的体外模型的总体平衡或体内稳态失衡,如何诱导一般的和特定的内皮应激的。FS(饥饿,培养基中含 5.5 mM 葡萄糖)PARS(血糖稳定状态,培养基中含 5.5 mM 葡萄糖和 65 pM 胰岛素)D1(I 型糖尿病模型,培养基中含 20 mM 葡萄糖)D2(II 型糖尿病模型,培养基中含 20 mM 葡萄糖和 65 pM 胰岛素)。
总结:为模拟肝、脂肪组织和内皮在机体内的不同占比,流动培养 48 h 后肝细胞、脂肪细胞和内皮细胞终浓度应为 10:2:1。流动培养时,肝细胞采用含有 3 D 支架的培养室,内皮细胞采用层流室。培养基的流速为 250 mL/min。
作为英国 Kirkstall 公司核心专利产品,Quasi Vivo 流动培养系统创新地模拟了体内动态环境,并可同时结合 3D 培养构建细胞模型。流动培养系统主要由高精度蠕动泵(用于培养基循环流动)、特殊设计的培养腔室(低通量培养用、中-高通量培养用)耗材组成。Quasi Vivo 设备可自行拼装,操作方便,按产品说明书清洗和灭菌后,耗材可长期、重复使用,大大降低了 Quasi Vivo 的使用成本。
Quasi Vivo流动培养系统产品型号
1、QV500:低通量培养;适用于单一细胞培养,腔室培养相同的细胞。
2、QV600:适用于多细胞共培养,每个腔室培养2种或以上细胞。

3、QV900:中-高培养培养;可用于多种细胞共培养,可以使管路上游的细胞培养基成为下游细胞的条件培养基。

Quasi Vivo参考文献
1.Tommaso S. et al., 2011. Engineering Quasi-Vivo in vitro organ models. Advances in Experimental Medicine and Biology Volume: 745, pp 138-153.
2.Patricia M. et al., 2018. A novel dynamic multicellular co-culture system for studying individual blood-brain barrier cell types in brain diseases and cytotoxicity testing. Scientific Reports Volume: 8, Issue: 1, pp 8784.
3.Basma E. et al. 2020. A dynamic perfusion based blood-brain barrier model for cytotoxicity testing and drug permeation. Scientific Reports Volume: 10, Issue: 1, pp 3788.
4.Miranda A. et al., 2016. A three dimensional (3D) human in vitro blood-brain barrier (BBB). Heart Volume: 102.
5.Buesch S. et al., 2018. A Novel In Vitro Liver Cell Culture Flow System Allowing Long-Term Metabolism and Hepatotoxicity Studies. Applied In Vitro Toxicology Volume: 4, Issue: 3, pp 232-237.
6.Alec O. et al., 2019. Development of an in vitro media perfusion model of Leishmania major macrophage infection. 2019 PLOS ONE Volume: 14, Issue: 7.
7.Sean M. et al., 2017. In-silico Characterisation of the Kirkstall QV900 In-Vitro System for Advanced Cell Culture. 5th International Conference on Computational and Mathematical Biomedical Engineering pp 1174-1177.
8.Ahluwalia A. et al., 2011. Hepatotoxicity of diclofenac in a Quasi-Vivo? multicompartment bioreactor. oxicology Letters Volume: 205.
9.Tomlinson, L. et al., 2019. In vitro liver zonation of primary rat hepatocytes.Front. Bioeng. Biotechnol., 7(17).
10.Elbakary, B. and Badhan R. K. S, 2020. A dynamic perfusion based blood brain barrier model for cytotoxicity testing and drug permeation. Scientific Reports, 10(1),3788.
11.O’Keefe, A. et al., 2019. Development of an in vitro media perfusion model of Leishmania major macrophage infection. Plos One, 14(7).
12.Miranda-Azpiazu, P. et al., 2018. A novel dynamic multicellular co-culture system for studying individual blood-brain barrier cell types in brain diseases. Scientific Reports, 8, 8784.
13.Chandorkar, P. et al., 2017. Fast-track development of an in vitro 3D lung/immune cell model to study Aspergillus infections. Scientific Reports, 7, 11644.
14.Iori, E. et al., 2012. Glucose and fatty acid metabolism in a 3 tissue in-vitro model challenged with normo- and hyperglycaemia. PLoS ONE, 7(4).
15.Mattei, G., Giusti, S. & Ahluwalia, A., 2014. Design Criteria for Generating Physiologically Relevant In Vitro Models in Bioreactors. Processes, 2(3). 16.Mazzei, D. et al., 2010. A low shear stress modular bioreactor for connected cell culture under high flow rates. Biotechnology and Bioengineering, 106.
17.Nithiananthan, S. et al., 2016. Physiological Fluid Flow Moderates Fibroblast Responses to TGF-β1. Journal of Cellular Biochemistry, 13.
18.Ramachandran, S.D. et al., 2015. In vitro generation of functional liver organoid-like structures using adult human cells. PLoS ONE, 10(10).
19.Rashidi, H. et al., 2016. Fluid shear stress modulation of hepatocyte like cell function. Archives of Toxicology, 90, 7.
20.Vinci, B. et al., 2012. An in vitro model of glucose and lipid metabolism in a multicompartmental bioreactor. Biotechnology Journal, 7.
21.Iori, E. et al., 2012. Glucose and fatty acid metabolism in a 3 tissue in-vitro model challenged with normo- and hyperglycaemia. PLoS ONE, 7(4), pp.1–9.
22.Mattei, G., Giusti, S. & Ahluwalia, A., 2014. Design Criteria for Generating Physiologically Relevant In Vitro Models in Bioreactors. Processes, 2, pp.548–569.
23.Mazzei, D. et al., 2010. A low shear stress modular bioreactor for connected cell culture under high flow rates. Biotechnology and Bioengineering, 106, pp.127–137.
24.Nithiananthan, S. et al., 2016. Physiological Fluid Flow Moderates Fibroblast Responses to TGF-β1. Journal of cellular biochemistry, 13(October), pp.1–13. Available at:
25.Ramachandran, S.D. et al., 2015. In vitro generation of functional liver organoid-like structures using adult human cells. PLoS ONE, 10(10), pp.1–14.
26.Rashidi, H. et al., 2016. Fluid shear stress modulation of hepatocytelike cell function. Archives of Toxicology, pp.3–7.
27.Iori, E. et al., 2012. Glucose and fatty acid metabolism in a 3 tissue in-vitro model challenged with normo- and hyperglycaemia. PLoS ONE, 7(4).
28.Vinci, B. et al., 2011. Modular bioreactor for primary human hepatocyte culture: Medium flow stimulates expression and activity of detoxification genes. Biotechnology Journal, 6, pp.554–564.
29.Tommaso S. et al., 2011. Engineering Quasi-Vivo in vitro organ models. Advances in Experimental Medicine and Biology Volume: 745, pp 138-153.
30.Ahluwalia A. et al., 2011. Hepatotoxicity of diclofenac in a Quasi-Vivo? multicompartment bioreactor. oxicology Letters Volume: 205.